Theoretische Grundlagen
Die schon länger bekannten theoretischen Grundlagen kann man hier1 nachlesen, da das aber kaum einer macht, und die Information in anderen Bereichen als unter “Schadmechanismen” abgelegt sind, habe ich sie dem Artikel vorangestellt.
Was ist Amyloidose?
“Mit dem Begriff Amyloidose fasst man Erkrankungen zusammen, die auf einer Proteinfehlfaltung beruhen. Sie sind durch eine typischerweise extrazelluläre Ablagerung von unlöslichen, polymeren Proteinfibrillen gekennzeichnet, die man Amyloid nennt.”2
Bei Amyloidose ist es also generell erst einmal egal, was fehlgefaltet hat, solange es ein Protein ist. Welches Protein es ist, ist dabei medizinisch somit erst einmal irrelevant.
Was sind Amyloide?
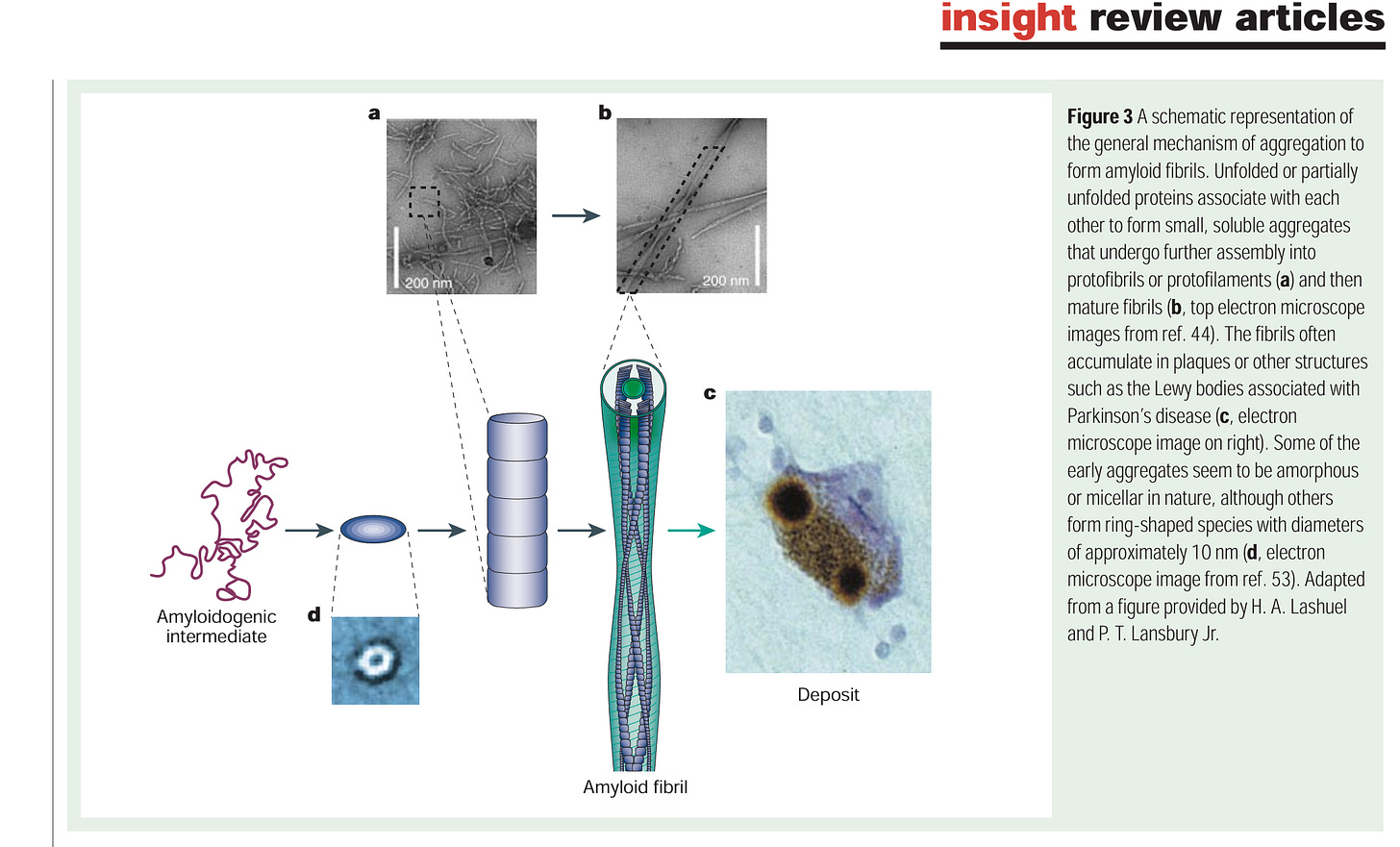
“Abbildung 3A Schematische Darstellung des allgemeinen Mechanismus der Aggregation zur Bildung von Amyloidfibrillen. Entfaltete oder teilweise entfaltete Proteine verbinden sich miteinander zu kleinen, löslichen Aggregaten, die sich weiter zu Protofibrillen oder Protofilamenten (a) und dann zu reifen Fibrillen (b, obere Elektronenmikroskopaufnahmen aus Ref. 44) zusammenlagern. Die Fibrillen sammeln sich häufig in Plaques oder anderen Strukturen wie den Lewy-Körperchen, die mit der Parkinson-Krankheit assoziiert sind (c, Elektronenmikroskopaufnahme rechts). Einige der frühen Aggregate scheinen amorph oder mizellär zu sein, während andere ringförmige Strukturen mit Durchmessern von etwa 10 nm bilden (d, Elektronenmikroskopaufnahme aus Ref. 53). Adaptiert aus einer Abbildung von H. A. Lashuel und P. T. Lansbury Jr.”3
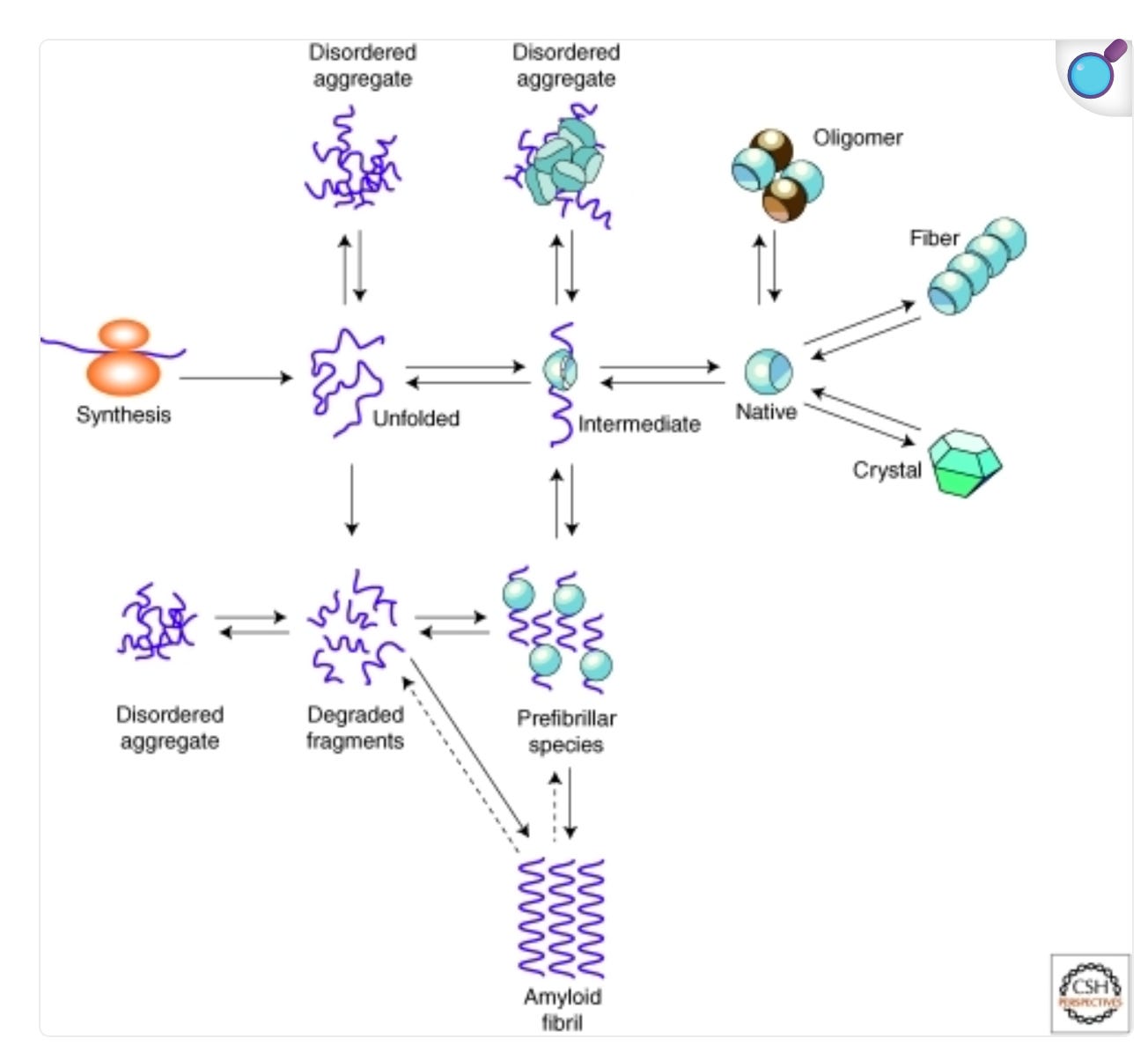
Eigentlich sind Amyloide etwas vollkommen normales. Protein falten täglich falsch. Das passiert bei jedem Protein, bei jedem Menschen, täglich. Das ist normalerweise kein Grund zu Panik.
“Proteinverhalten in der Zelle. Proteinhomöostase bezeichnet die Fähigkeit von Zellen, die Konzentration ihrer Proteine hinsichtlich Konformation, Interaktion, Konzentration und zellulärer Lokalisierung zu regulieren. Wenn Proteine sich nicht richtig falten oder ihre Faltung nicht aufrechterhalten können, kann es zu Fehlfaltungen und Aggregationen kommen, die mit einer Vielzahl von Erkrankungen des Menschen in Verbindung gebracht werden, darunter Alzheimer und Parkinson.”4
Die Natur hat dafür schon eine Lösung: Chaperone (Eng. Kindermädchen). Chaperone sind Proteine, die fehlgefaltete Proteine rückfalten.
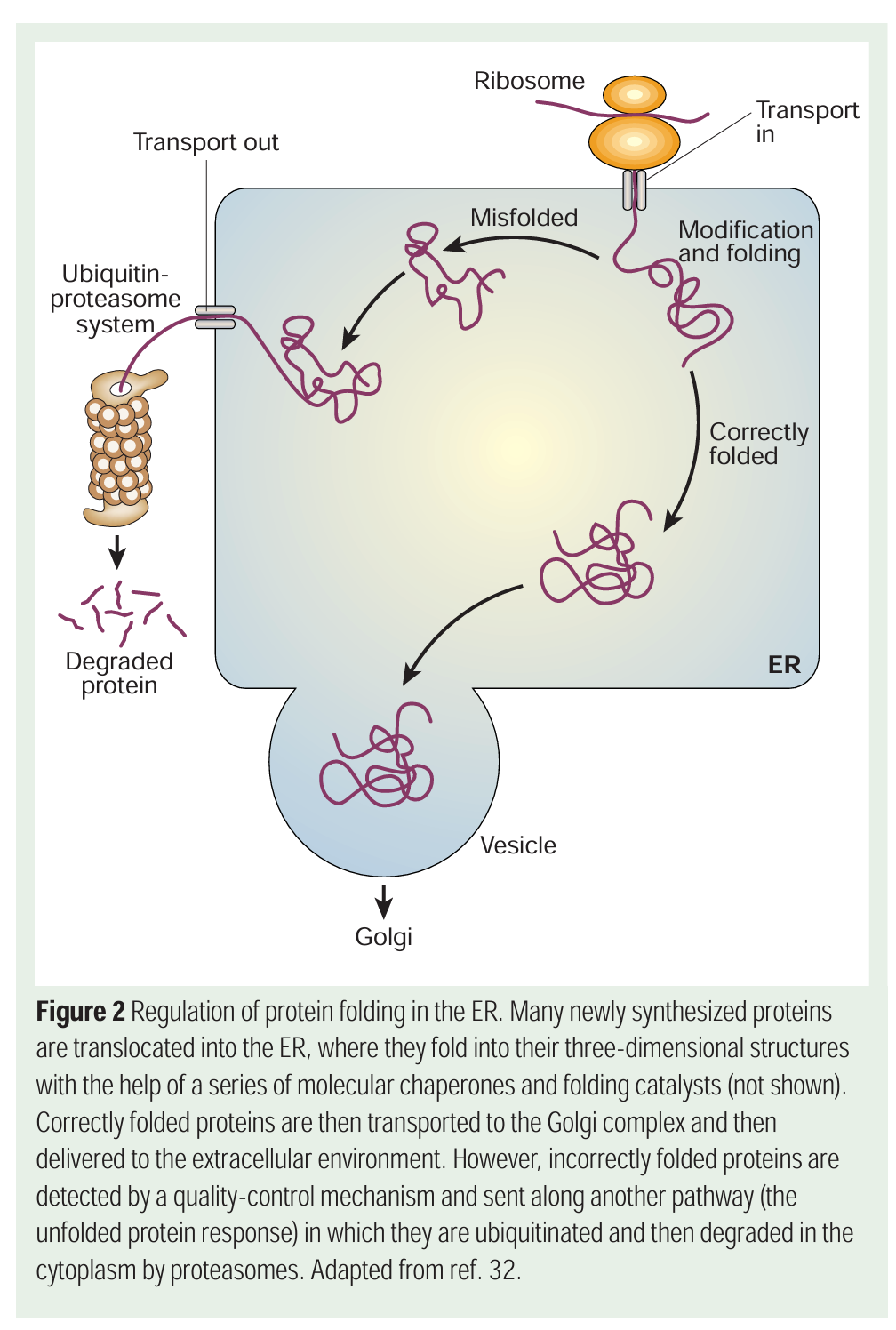
“Abbildung 2 Regulierung der Proteinfaltung im ER. Viele neu synthetisierte Proteine werden in den ER transportiert, wo sie mit Hilfe einer Reihe von molekularen Chaperonen und Faltungskatalysatoren (nicht dargestellt) zu ihren dreidimensionalen Strukturen gefaltet werden. Korrekt gefaltete Proteine werden dann zum Golgi-Komplex transportiert und anschließend an die extrazelluläre Umgebung abgegeben. Falsch gefaltete Proteine werden jedoch durch einen Qualitätskontrollmechanismus erkannt und auf einen anderen Weg (die Unfolded Protein Response) geleitet, wo sie ubiquitiniert und anschließend im Zytoplasma durch Proteasomen abgebaut werden. Adaptiert aus Ref. 32.”5
Sind Amyloide und Chaperone im Gleichgewicht, passiert erst mal gar nichts.
“Von besonderer Bedeutung in diesem Zusammenhang sind die zahlreichen molekularen Chaperone, die in allen Zelltypen und Zellkompartimenten vorkommen. Einige Chaperone interagieren mit neu entstehenden Ketten, sobald diese aus dem Ribosom austreten, während andere an der Steuerung späterer Stadien des Faltungsprozesses beteiligt sind. Molekulare Chaperone arbeiten oft zusammen, um sicherzustellen, dass die verschiedenen Stadien der Faltung solcher Systeme effizient abgeschlossen werden. […] Molekulare Chaperone erhöhen nicht selbst die Geschwindigkeit einzelner Schritte der Proteinfaltung, sondern sie steigern die Effizienz des Gesamtprozesses, indem sie die Wahrscheinlichkeit konkurrierender Reaktionen, insbesondere der Aggregation, verringern. […] Trotz dieser Faktoren wäre es angesichts der enormen Komplexität und der stochastischen Natur des Faltungsprozesses bemerkenswert, wenn es nie zu Fehlfaltungen käme. Ein klarer Beweis dafür, dass molekulare Chaperone zur Verhinderung von Fehlfaltungen und deren Folgen notwendig sind, ist die Tatsache, dass die Konzentrationen vieler dieser Spezies während zellulären Stresses erheblich ansteigen; dies spiegelt sich auch in der Bezeichnung vieler dieser Proteine als Hitzeschockproteine (Hsps) wider. Es ist auch klar, dass einige molekulare Chaperone nicht nur Proteine während ihrer Faltung schützen können, sondern auch fehlgefaltete und sogar aggregierte Proteine retten und ihnen eine zweite Chance geben, sich korrekt zu falten6 7. Die aktive Intervention in den Faltungsprozess erfordert Energie, und ATP ist für die meisten molekularen Chaperone erforderlich, um mit voller Effizienz zu funktionieren. In eukaryotischen Systemen sind viele der in einer Zelle synthetisierten Proteine für die Sekretion in die extrazelluläre Umgebung bestimmt. Diese Proteine werden in den ER transportiert, wo sie vor der Sekretion durch den Golgi-Apparat gefaltet werden. Der ER enthält eine Vielzahl von molekularen Chaperonen und Faltungskatalysatoren, und darüber hinaus müssen die hier gefalteten Proteine vor ihrem Export eine „Qualitätskontrolle” durchlaufen (Abb. 2).
Man erkennt gleich zwei Probleme:
Chaperone scheinen spezialisiert zu sein. Das Spike-Protein ist körperfremd. Wie groß ist die Wahrscheinlichkeit, dass es passende Chaperone gibt?
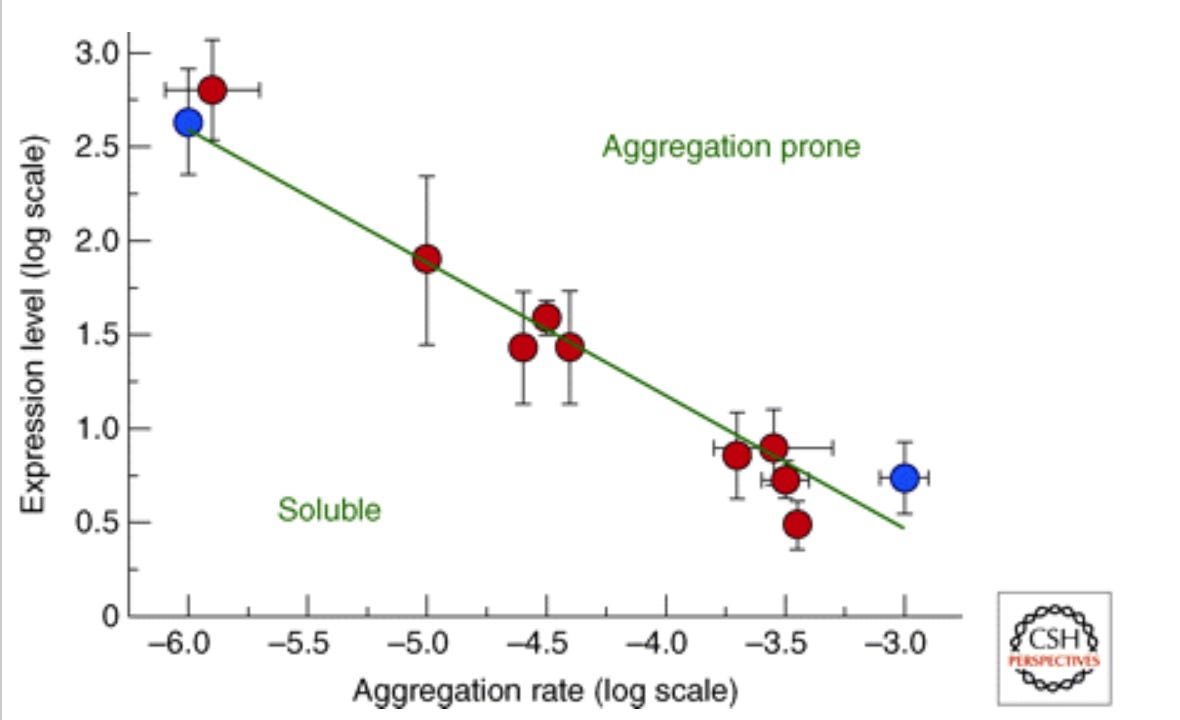
Wenn von einem Protein zu viel vorhanden ist im Verhältnis zu seiner Stabilität, wird es auch problematisch. Diese Theorie nennt sich “Life on the Edge” also Leben auf Messers Schneide. Das Spike-Protein ist thermostabil.8
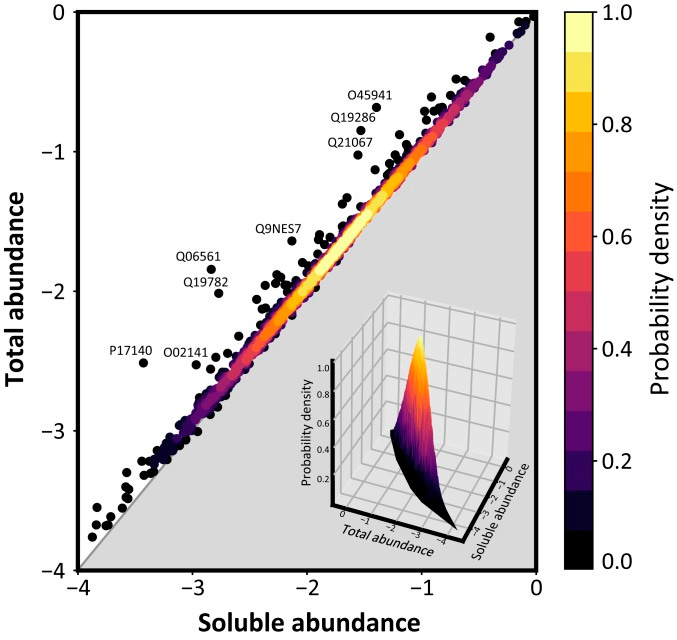
“Korrelation zwischen den mRNA-Expressionsniveaus in vivo und den Proteinaggregationsraten in vitro für eine Reihe von 11 menschlichen Proteinen, die entweder mit einer Krankheit in Zusammenhang stehen (rot) oder nicht (blau) “9
Was oberhalb der Geraden liegt beim Verhältnis von Menge zu Stabilität, flockt aus.
Das ist keine graue Theorie, das konnte im Fadenwurm C. elegans schön gezeigt werden.
“Vergleich zwischen den zellulären Konzentrationen und den kritischen Konzentrationen von Proteinen in adulten C. elegans. Dichteplot der Gesamtkonzentration (T) und der löslichen Konzentration (S) in logarithmischer Skala für die 1.163 Proteine, die mindestens an ihrer Löslichkeitsgrenze quantifiziert wurden.” 10
Das Spike Protein kann zum Amyloid werden
Nun haben wir das Phänomen, dass viele Menschen ein körperfremdes Protein möglicherweise in Mengen jenseits der Löslichkeit nach “Life on the Edge” produzieren.
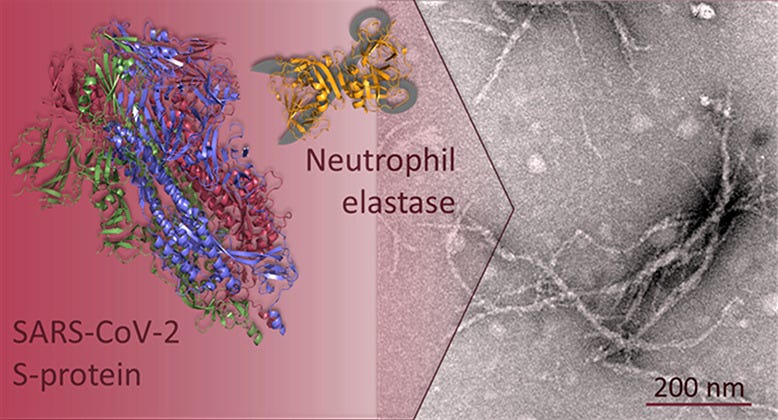
Zudem könnte es sein, dass einige (körpereigene) Enzyme, wie neutrophile Elastase, das Spike Protein ungeschickt schneiden, so dass es fehlfaltet und Amyloide bildet.
Sind das möglicherweise mit Bestandteile der “Calamari-Clots”?
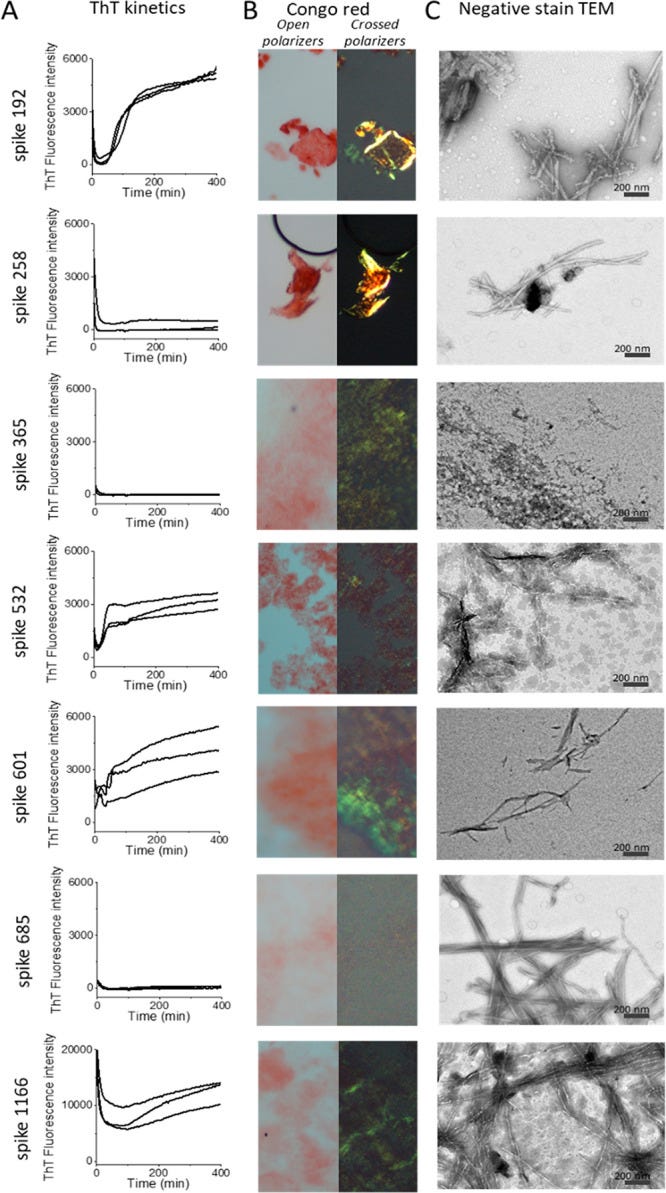
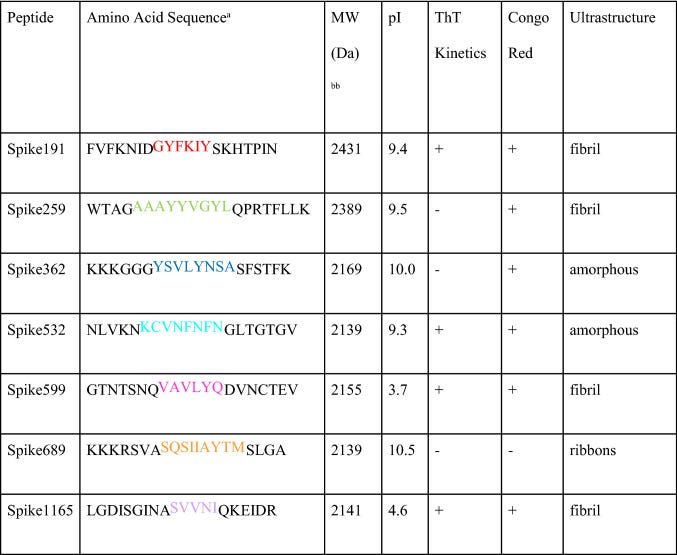
“Amyloidfibrillen-Assays von SARS-CoV-2-S-Peptiden (0,1 mg/ml). (A) ThT-Fluoreszenz-Fibrillenbildungskinetik. (B) Kongorot-Doppelbrechungsmikroskopie. (C) Negativfärbung-TEM-Ultrastruktur.”11
Dass das Spike-Protein potentiell amyloid ist, kann man mittlerweile in Übersichtsartikeln nachlesen.12
“COVID-19 ist in jüngster Zeit die größte Bedrohung für unsere Existenz und führt in Verbindung mit dem seit langem bekannten Mechanismus der Amyloidogenese zu verschlimmerten Komplikationen und Morbiditäten bei kritischen amyloidogenen Erkrankungen wie ATTR (Transthyretin-Amyloidose). Die S-Protein- und N-Protein-Amyloidogenese, die jeweils durch Endoproteolyse und Proteastase des zellulären αS-Proteins verursacht wird, kann zu Aggregation und Amyloidbildung führen, die in Zukunft neurodegenerative und andere amyloidogene kardiale und neurale Komplikationen verursachen können. Darüber hinaus müssen die Nebenwirkungen der COVID-19-Impfung, bei der genau diese Proteine als Hauptantigene verwendet werden, sorgfältig untersucht werden, um das Auftreten von amyloidogenen pathologischen Zuständen bei Personen nach einer SARS-CoV-2-Infektion und die Verschlimmerung häufiger Morbiditäten zwischen COVID-19 und kritischen amyloidogenen Erkrankungen wie ATTR zu verhindern.”13
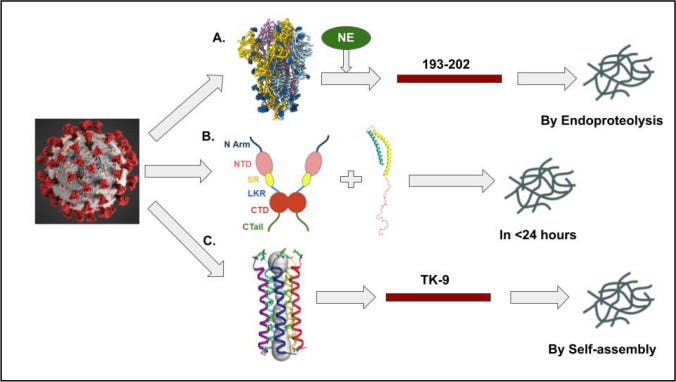
“Grafische Darstellung des SARS-CoV-2-Proteins während/bei Beschleunigung der Amyloidogenese; A Durch Serinproteasen wie Neutrophilenesterase verdautes S-Protein führt zur Bildung des amyloidprone Segments 193–202, das später Amyloide bildet; B N-Protein (links) interagiert mit dem amyloidogenen α-Synuclein-Protein (rechts) und führt zu einer Beschleunigung der Amyloidogenese; C E-Protein destabilisiert sich durch hydrophobe Wechselwirkungen mit der Umgebung zu einem Neun-Rest-Segment TK9, das durch Selbstorganisation Amyloide bildet.”14
“aDie farblich gekennzeichneten Reste bezeichnen die von WALTZ vorhergesagten amyloidogenen Segmente. Grau hervorgehoben sind nicht-native Aminosäuren, die zur Verbesserung der Löslichkeit eingeführt wurden.
bTheoretisches Molekulargewicht (Dalton)”15
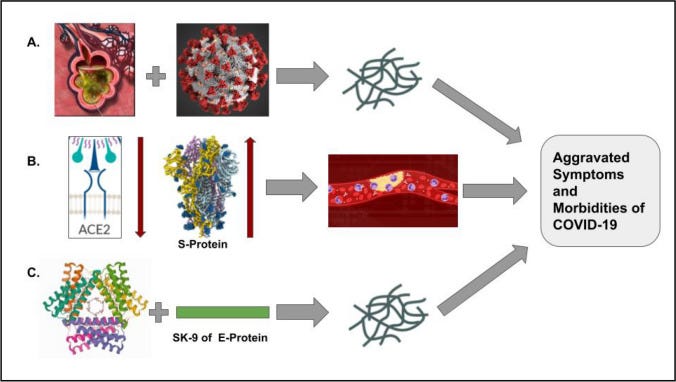
“Grafische Darstellung der Auswirkungen von SARS-CoV-2 auf bereits vorhandene amyloidogene Einheiten in unserem Körper; A Flüssigkeitsgefüllte Alveolen (links) eines ARDS-Patienten unter dem Einfluss von COVID-19 führen zu einer erhöhten Neigung zur Amyloidose; B Die Herunterregulierung von ACE-2 und die Hochregulierung von S-Protein in der Lunge nach einer COVID-Infektion führen zur Bildung von amyloidischen Mikrogerinnseln in den Lungengefäßen; C Natives Serum-Amyloid-A-Hexamer durchläuft in Gegenwart eines neun Resten umfassenden Segments des E-Proteins, das als SK9 bezeichnet wird, mehrere Stoffwechselwege und führt schließlich zur Bildung von Amyloidfibrillen; All diese Ergebnisse führen schließlich zu einem Ergebnis, nämlich einer Verschlimmerung der COVID-ähnlichen Symptome und der Schwere der Begleiterkrankungen.” 16
Das Spike-Protein bindet Fibrinogen
Ein weiteres, schon länger bekanntes Problem ist, dass das Spike-Protein an Fibrinogen bindet und den Abbau dieses Fibrinogens behindert bzw. zumindest massiv erschwert.
Experimentelle Daten
Verändertes Amyloid-Plasmaprofil bei Patienten mit behindernden Kopfschmerzen nach SARS-CoV-2-Infektion und Impfung
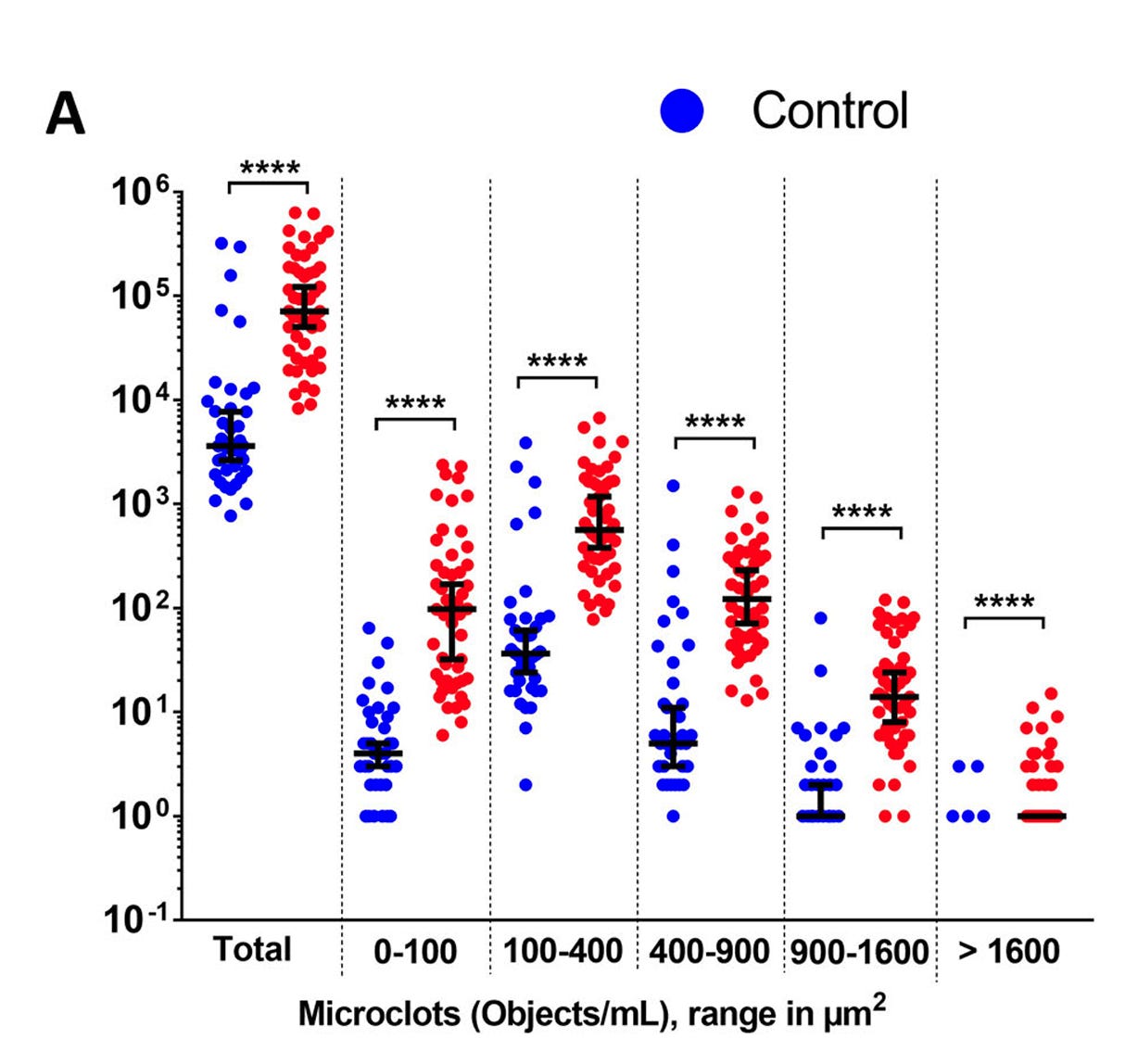
Alle Probanden, gesunde und Long Covid Patienten, haben Microclots!
Soweit die Theorie. Eine Theorie muss aber in der Realität bewiesen werden. Der letzte experimentelle Beleg aus Geimpften fehlte bisher und SPOILER er ist immer noch nicht wirklich da.
Thierry AR, Usher T, Sanchez C, Turner S, Venter C, Pastor B, Waters M, Thompson A, Mirandola A, Pisareva E, Prevostel C, Laubscher GJ, Kell DB, Pretorius E. Circulating Microclots Are Structurally Associated With Neutrophil Extracellular Traps and Their Amounts Are Elevated in Long COVID Patients. J Med Virol. 2025 Oct;97(10):e70613. doi: 10.1002/jmv.70613. PMID: 41036702; PMCID: PMC12489976. https://pubmed.ncbi.nlm.nih.gov/41036702/
Probanden: 38 gesunde Menschen + 50 Long Covid Patienten
“Die Kontrollkohorten waren wie folgt: eine aus Südafrika [SA-Kontrollen, (n = 14)] und eine weitere aus Frankreich [EFS-Kontrollen, (n = 24)], beide bestehend aus gesunden Personen ohne LC-Symptome zum Zeitpunkt der Blutentnahme.”
“Für die Long-Covid-Gruppe (LC) wurden 50 Patienten [18 Männer, 32 Frauen; Durchschnittsalter 50 (±17)] über klinische Kooperationspartner rekrutiert, die Personen mit anhaltenden LC-Symptomen nach einer akuten COVID-19-Erkrankung identifiziert hatten.“
Microclot Analyse:
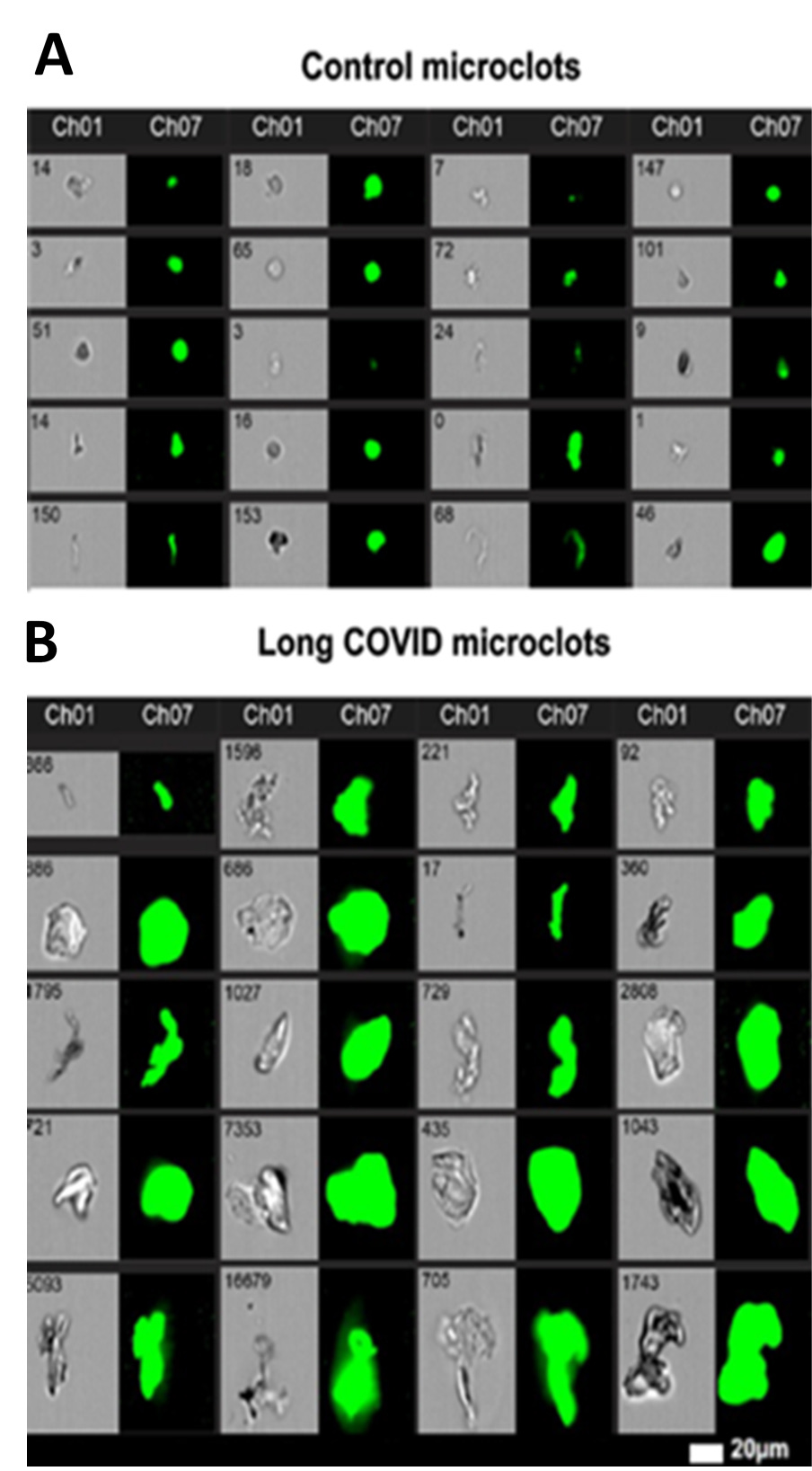
“Abb. S1. Vergleich der Anzahl von Mikrogerinnseln im Plasma gesunder Personen (HI) und LC-Patienten (LC), bestimmt durch Durchflusszytometrie anhand verschiedener Parameter: Die Bilder stellen Mikroskopaufnahmen dar, die mit Hilfe der bildgebenden Durchflusszytometrie von unseren Kontrollkohorten (n = 38) und LC-Kohorten (n = 50) aufgenommen wurden. Die Bilder wurden sowohl mit Hellfeld- (Ch01) als auch mit Fluoreszenz- (Ch07) Bildgebung aufgenommen.”
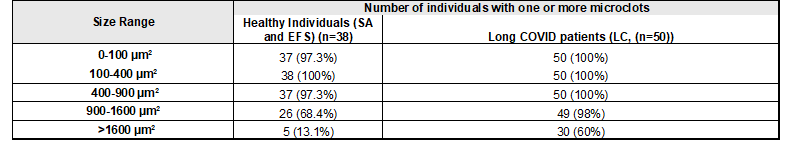
“Tabelle S11: Anzahl der Personen mit einem oder mehreren HFAP (Mikrogerinnseln) bei Long-COVID-Patienten (LC) und gesunden Personen.”
ALLE Probanden, ob gesund oder LC-Patienten hatten Microclots! Die “Gesunden” nur weniger von den großen Exemplaren. Das hat auch Dr. Beate Jäger aus dem St. Georgs Krankenhaus in Bad Aibling berichtet. Sie sieht kaum noch normales Blut.
Das deckt sich mit den Daten von Holger und mir, wir sind ungeimpft.17
Nur ist es leider so, dass zwar die LC-Patienten nach der COVID-Injektionshistorie gefragt wurden aber es keine diesbezüglichen Infos bei den “Gesunden” gibt.
Da aber alle 38 “Gesunden” Microclots haben im Bereich von 100-400µm² und alle bis auf einen oder 2 im Bereich bis 900 µm² hatten, wäre das wichtig gewesen.
Update des Impfstatus der gesunden “Kontrolle” (20.11.2025)
Der Impfstatus findet sich in den Supplementary Materials auf Seite 9.
Leider steht nicht, womit die “Gesunden” Probanden geimpft waren.
Das heißt aber auch, dass es keine ungeimpften Probanden in der “Gesunden” Gruppe gab.
Leider ist nicht markiert, welche der Long-Covid-Daten von den Ungeimpften stammen.
NETs
Die Autoren verfolgen eher die Theorie der NETose und weniger der Spike-Amyloide.
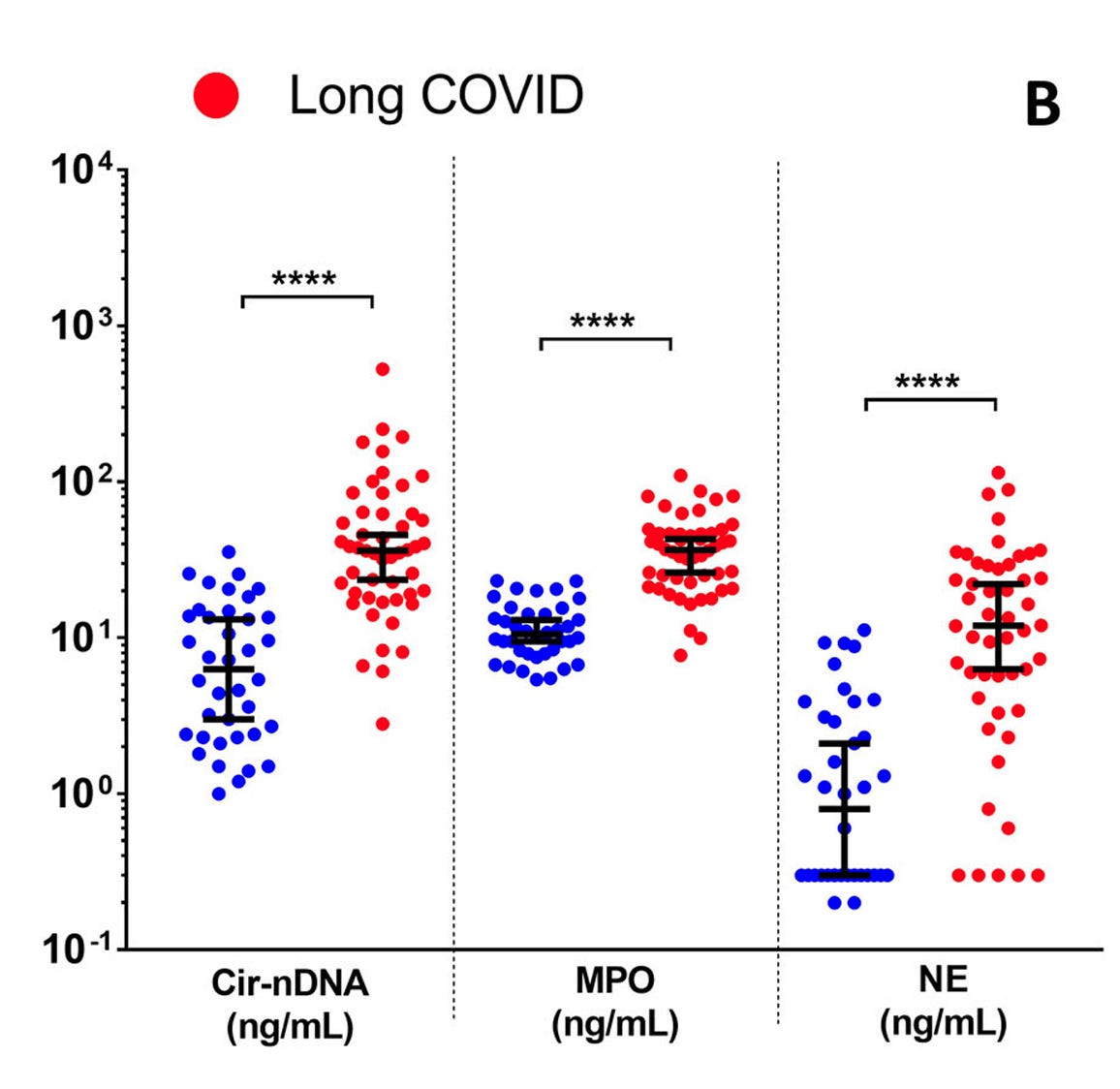
“Die Bildung von NETs (NETose) wird durch aktivierte Neutrophile ausgelöst und ist Teil der angeborenen Immunantwort. NETs bestehen aus Chromatin und mehreren Proteinen, die insbesondere aus Granula stammen (z. B. Neutrophilen-Elastase, Myeloperoxidase, bakteriziden Peptiden, Cathepsin G, Lactoferrin und Matrix-Metalloproteinase-9), die jeweils zur Eliminierung von Bakterien beitragen. Dadurch können NETs Mikroben innerhalb der ersten Stunden nach der Infektion eliminieren, und zwar physikalisch mittels der DNA-Fasern und chemisch mittels potenter Enzyme (z. B. NE und MPO). Eine unkontrollierte und übermäßige NET-Bildung kann jedoch schädlich sein und wurde mit verschiedenen sterilen und nicht sterilen Erkrankungen in Verbindung gebracht, die als NETopathien bezeichnet werden. […] DNA ist der Hauptbestandteil von NETs, und die wichtigsten Nebenprodukte von NETs bestehen aus spezifisch abgebauter oder fragmentierter DNA, die in den Blutkreislauf abgegeben wird (zirkulierende DNA, cirDNA).”
Auch bei den NETs scheinen die “Gesunden” betroffen, nur nicht so stark.
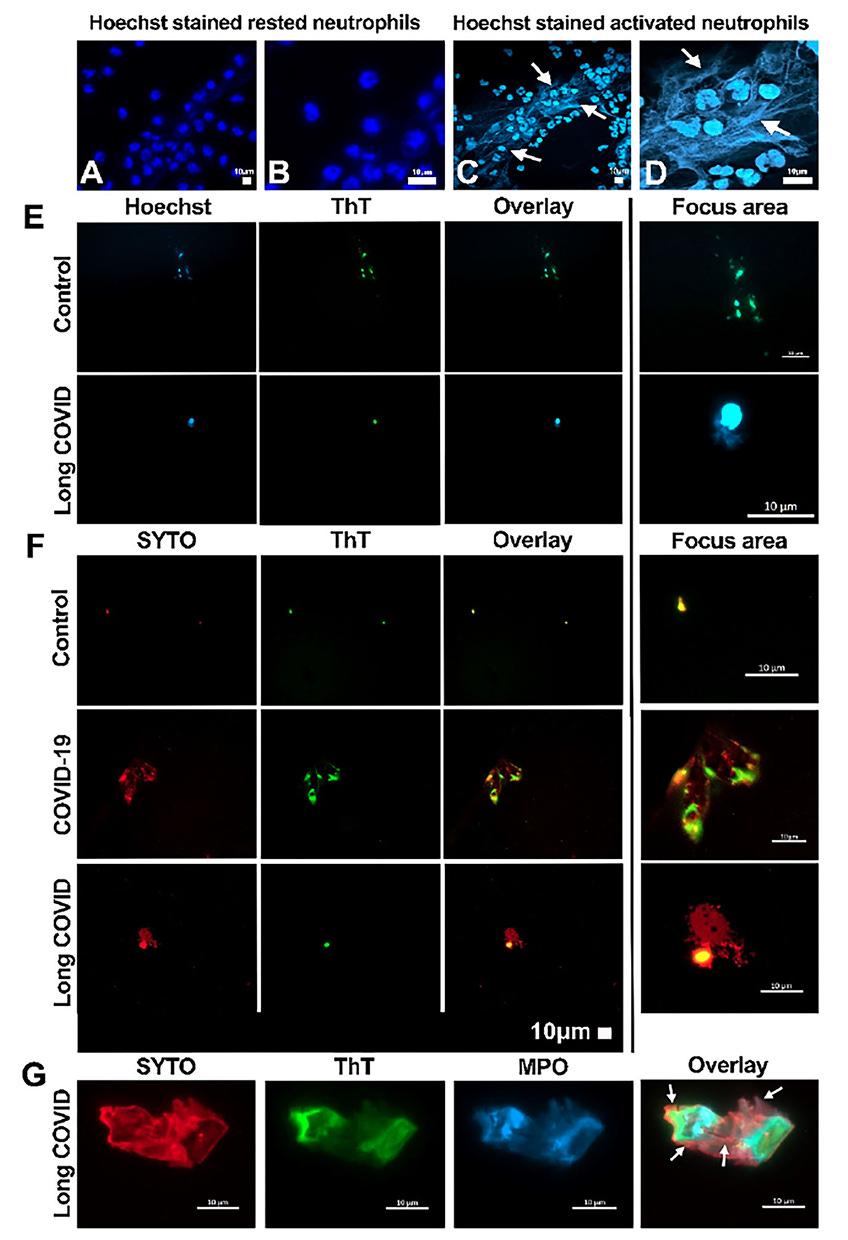
“Fluoreszenzmikroskopische Aufnahmen, die Beispiele für die Bildung von NETs aus ruhenden (A und B) und aktivierten (C und D) Neutrophilen zeigen. Die Aktivierung von „ex vivo“ kultivierten isolierten menschlichen Neutrophilen erfolgte durch eine 6-stündige Behandlung mit PMA. Ebenfalls gezeigt sind mikroskopische Beispiele für mit Thioflavin T (ThT) nachgewiesene Mikrogerinnsel und NET-Nachweise unter Verwendung von Hoechst-Färbung oder SYTO-Färbung bei verschiedenen entzündlichen Erkrankungen, darunter akutes COVID-19 und LC, im Vergleich zur Kontrolle. Die ersten beiden Spalten zeigen die Hoechst- (blau) oder SYTO- (rot) und ThT-Färbung (grün) separat, mit der Überlagerung in Spalte drei. Der Bereich von Interesse wurde in der letzten Spalte (E und F) hervorgehoben. Die letzte Reihe der Mikroskopaufnahmen (G) zeigt Beispiele für PPP mit Myeloperoxidase (MPO) (blau) und SYTO (DNA-rot), die im Mikrogerinnsel (ThT-grün) erfasst wurden (die Pfeile zeigen die spezifische Lokalisierung der DNA, die NETs um das Mikrogerinnsel herum, NETs außerhalb des Mikrogerinnsels (die an die beiden sichtbaren Mikrogerinnsel gebunden sind) oder (zwischen den beiden sichtbaren Mikrogerinnseln). Die Versuchsbedingungen für die hier vorgestellten Ergebnisse bestehen darin, dass gelagertes plättchenarmes Plasma (PPP) Thioflavin T und Hoechst oder SYTO und MPO ausgesetzt wurde, um Mikrogerinnsel nachzuweisen.”
Alle sind unterschiedlich stark betroffen, die “Gesunden” jedoch deutlich geringer stark.
Schlussfolgerung der Autoren:
“Mikrogerinnsel treten häufig bei chronischen Entzündungszuständen auf und sind widerstandsfähiger gegenüber Fibrinolyse, wobei sie selbst gegenüber starken proteolytischen Enzymen wie Trypsin resistent sind. Wir stellen die Hypothese auf, dass eine unausgewogene NET-Bildung, wie sie bei verschiedenen entzündlichen Erkrankungen wie COVID-19 oder LC beobachtet wird, zu einer höheren Stabilität der Mikrogerinnsel und damit zu einer erhöhten Anzahl im Blutkreislauf führen könnte. Eine solche Resistenz gegenüber normalen Abbaumechanismen und die Variabilität ihrer Bildung, selbst ohne typische Gerinnungsauslöser wie Thrombin, würde darauf hindeuten, dass Mikrogerinnsel weitreichendere und klinisch schädliche Auswirkungen haben könnten. Diese Studie zeigt einen starken Zusammenhang zwischen Biomarkern, die auf thromboinflammatorische Aktivität hinweisen, und LC. Da unsere Studie gezeigt hat, dass NETs ein Bestandteil zirkulierender Mikrogerinnsel sein können, vermuten wir, dass eine erhöhte NET-Bildung die Stabilisierung von Mikrogerinnseln im Blutkreislauf fördert, was zu schädlichen Auswirkungen führt, die (zum Teil) zu den Symptomen von LC beitragen können. Die Entdeckung dieser Biomarker-Zusammenhänge bietet nicht nur eine mögliche neue Diagnosemethode, sondern auch neue therapeutische Ansatzpunkte, die Aussichten auf eine deutlich verbesserte klinische Behandlung in der Zukunft eröffnen. Folglich stellen unsere Ergebnisse einen bedeutenden Fortschritt im Verständnis der Wechselwirkungen zwischen NETs und Mikrogerinnseln bei Long COVID dar.”
Meine Schlussfolgerung:
Das Paper hat für mich ein paar Probleme:
Alle “Gesunden” waren Geimpft. Keine Kontrollgruppe aus ungeimpften Gesunden. Damit handelt es sich nur um eine Impfschadensstudie und wie unterschiedlich stark ausgeprägt die Microclots sein können. Keine Informationen über die Art der Impfung oder Impfcharge.
Keine Färbung auf Spike Proteine. Sind diese noch vorhanden, potentiell gebunden an Fibrinogen? Das wurde nicht untersucht.
“Obwohl Fibrinogen ein zentraler Bestandteil und Gerüst einiger Mikrogerinnsel ist, bindet ThT an jedes amyloidogene und fehlgefaltete Protein, das mit dem Mikrogerinnsel assoziiert ist oder in dieses eingebaut ist. Es ist wahrscheinlich, dass die meisten der dysregulierten Entzündungsmoleküle, die wir in den Mikrogerinnseln gefunden haben, selbst eine signifikante Amyloidogenität aufweisen.” - D. h. die ThT Färbung unterscheidet nicht zwischen Fibrinogen oder amyloidem Spike. Diese Frage kann mit diesem Paper also nicht geklärt werden, man kann nur sagen, es ist etwas amyloides, dessen Ursprung nicht geklärt ist.
Das Paper von Thierry et al. ist mir biochemisch zu grob. Es sagt “nur” dass alle COVID-”geimpften” Menschen aktuell wohl Microclots haben, nur unterschiedlich groß. Keine Referenz aus vor 2020, keine Ungeimpften Gesunden als Kontrolle. Das normalisiert Microclots. Ist es normal, dass auch “Gesunde” Microcolts haben? Aus eigener Erfahrung kann ich nur sagen, ich als Ungeimpfte habe das Problem auch und laut Beate Jäger war das nicht immer so.
Unterscheiden sich die Microclots der “Gesunden” biochemisch von jenen der LC-Gruppe? Mehr Fibrinogen in Ungeimpften und oder mehr Spike (gebunden an Fibrinogen oder Spike-Amyloid) bei LC-Patienten?
Mehr als dass alle eine Microclot Problem haben und dass es ein amyloides Problem ist, sagt das Paper leider nicht.
Ich gehe also nicht mit Nicolas Hulscher konform, dass das Rätsel damit biochemisch gelöst wäre, nicht ansatzweise.
Mögliche Behandlung?
Ich bin kein Arzt, ich kann nur Beispiele nennen oder Publikationen. Da ich selbst das Microclot Problem habe, verweise ich auf Holgers und meinen Behandlungsplan aus dem St. Georg Krankenhaus.18 3 verschiedene Blutverdünner gleichzeitig.
Des weiteren sind Prionen eine Art Amyloid ABER nicht alle Amyloide sind priogen. Was gegen Prionen hilft, könnte auch bei Amyloiden helfen, sage ich aus eigener Erfahrung, weil Amyloide das einzige Problem waren, das Holger und ich nicht haben. Wir nehmen viel Methylenblau zu uns.
Aus den Erfahrungen von LC-Patienten in unserem Umfeld wird rückgemeldet, dass MB bei den Müdigkeits- und Erschöpfungssymptomen bei vielen Betroffenen helfen, vielleicht auch, weil Methylenblau Entzündungen reduziert.19
Ansonsten haben aktuell zufällig zwei große Pharmakonzerne neue Produkte für das Problem auf den Markt gebracht.20
Update
20.11.2025: Impfstatus der “Gesunden” Kontrolle aus den Supplementary Materials.
Amyloidose - DocCheck Flexikon https://flexikon.doccheck.com/de/Amyloidose
Dobson CM. Protein folding and misfolding. Nature. 2003 Dec 18;426(6968):884-90. doi: 10.1038/nature02261. PMID: 14685248. https://pubmed.ncbi.nlm.nih.gov/14685248/
Vendruscolo M, Knowles TP, Dobson CM. Protein solubility and protein homeostasis: a generic view of protein misfolding disorders. Cold Spring Harb Perspect Biol. 2011 Dec 1;3(12):a010454. doi: 10.1101/cshperspect.a010454. PMID: 21825020; PMCID: PMC3225949. https://pmc.ncbi.nlm.nih.gov/articles/PMC3225949/
Dobson CM. Protein folding and misfolding. Nature. 2003 Dec 18;426(6968):884-90. doi: 10.1038/nature02261. PMID: 14685248. https://pubmed.ncbi.nlm.nih.gov/14685248/
Bukau B, Horwich AL. The Hsp70 and Hsp60 chaperone machines. Cell. 1998 Feb 6;92(3):351-66. doi: 10.1016/s0092-8674(00)80928-9. PMID: 9476895. https://pubmed.ncbi.nlm.nih.gov/9476895/
Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science. 2002 Mar 8;295(5561):1852-8. doi: 10.1126/science.1068408. PMID: 11884745. https://pubmed.ncbi.nlm.nih.gov/11884745/
Vendruscolo, M., Knowles, T. P. J., & Dobson, C. M. (2011). Protein Solubility and Protein homeostasis: A Generic view of protein misfolding Disorders. Cold Spring Harbor Perspectives in Biology, 3(12), a010454. https://doi.org/10.1101/cshperspect.a010454 https://cshperspectives.cshlp.org/content/3/12/a010454/F5.expansion.html#ref-52
Vecchi G, Sormanni P, Mannini B, Vandelli A, Tartaglia GG, Dobson CM, Hartl FU, Vendruscolo M. Proteome-wide observation of the phenomenon of life on the edge of solubility. Proc Natl Acad Sci U S A. 2020 Jan 14;117(2):1015-1020. doi: 10.1073/pnas.1910444117. Epub 2019 Dec 31. PMID: 31892536; PMCID: PMC6969518. https://pubmed.ncbi.nlm.nih.gov/31892536/
Nyström S, Hammarström P. Amyloidogenesis of SARS-CoV-2 Spike Protein. J Am Chem Soc. 2022 May 25;144(20):8945-8950. doi: 10.1021/jacs.2c03925. Epub 2022 May 17. PMID: 35579205; PMCID: PMC9136918. https://pubmed.ncbi.nlm.nih.gov/35579205/
Leung WY, Wu HHL, Floyd L, Ponnusamy A, Chinnadurai R. COVID-19 Infection and Vaccination and Its Relation to Amyloidosis: What Do We Know Currently? Vaccines (Basel). 2023 Jun 24;11(7):1139. doi: 10.3390/vaccines11071139. PMID: 37514955; PMCID: PMC10383215. https://pmc.ncbi.nlm.nih.gov/articles/PMC10383215/
Seth P, Sarkar N. A comprehensive mini-review on amyloidogenesis of different SARS-CoV-2 proteins and its effect on amyloid formation in various host proteins. 3 Biotech. 2022 Nov;12(11):322. doi: 10.1007/s13205-022-03390-1. Epub 2022 Oct 13. PMID: 36254263; PMCID: PMC9558030. https://pmc.ncbi.nlm.nih.gov/articles/PMC9558030/
Seth P, Sarkar N. A comprehensive mini-review on amyloidogenesis of different SARS-CoV-2 proteins and its effect on amyloid formation in various host proteins. 3 Biotech. 2022 Nov;12(11):322. doi: 10.1007/s13205-022-03390-1. Epub 2022 Oct 13. PMID: 36254263; PMCID: PMC9558030. https://pmc.ncbi.nlm.nih.gov/articles/PMC9558030/
Seth P, Sarkar N. A comprehensive mini-review on amyloidogenesis of different SARS-CoV-2 proteins and its effect on amyloid formation in various host proteins. 3 Biotech. 2022 Nov;12(11):322. doi: 10.1007/s13205-022-03390-1. Epub 2022 Oct 13. PMID: 36254263; PMCID: PMC9558030. https://pmc.ncbi.nlm.nih.gov/articles/PMC9558030/
Seth P, Sarkar N. A comprehensive mini-review on amyloidogenesis of different SARS-CoV-2 proteins and its effect on amyloid formation in various host proteins. 3 Biotech. 2022 Nov;12(11):322. doi: 10.1007/s13205-022-03390-1. Epub 2022 Oct 13. PMID: 36254263; PMCID: PMC9558030. https://pmc.ncbi.nlm.nih.gov/articles/PMC9558030/
Gureev AP, Sadovnikova IS, Popov VN. Molecular Mechanisms of the Neuroprotective Effect of Methylene Blue. Biochemistry (Mosc). 2022 Sep;87(9):940-956. doi: 10.1134/S0006297922090073. PMID: 36180986. https://pubmed.ncbi.nlm.nih.gov/36180986/




“Vaccination status of participants before blood collection”
SA healthy individuals (HI, SA) (n = 14) 14 Vaccinated
French healthy individuals (HI, EFS) (n = 24) 24 Vaccinated
Long COVID patients (LC) (n = 50) 45 Vaccinated; 4 Unvaccinated; 1 Unknown
(Seite 9 in den supplementary files)
https://assets-eu.researchsquare.com/files/rs-4666650/v1/c72b14506b3bff679e6ebbd9.pdf
Ich hatte den Bericht zuerst von Nicholas Hulscher gelesen. Da stand, dass die gesunden alle geimpft waren, bei den LC‘s 45 geimpft, 4 ungeimpft und 1 unbekannt.