Wie man sich aus seinen eigenen Worten einen Strick dreht, weiß auch das PEI
PEI wie PEInlich – getroffene Hunde bellen, aber beißen nicht.
Auf mehrfache Anfrage hin, widme ich mich dem vierseitigen PEI-Brief vom 22.12.23 an die Ärzte bzw. medizinischen Fachkreise und unterziehe dem Brief einer Literaturanalyse wie ich das bei Ugurs „Project Lightspeed“ gemacht habe, nur mit etwas weniger schwarzem Humor.
Hier findet man den vierseitigen Brief des PEI im Original:
Dass das PEI keine Ahnung hat, wovon es redet, habe ich bereits in diesem Artikel anhand der LNPs durchexerziert:
Entweder hat das PEI wirklich absolut keine Ahnung, oder es lügt wie gedruckt
Das PEI hat auf seiner Homepage mal wieder seine Unwissenheit öffentlich zur Schau gestellt. Diesmal haben sie sich bei den Lipidnanopartikeln bzw. den darin verwendeten Lipiden so richtig wissenschaftlich blamiert. Falls das dem geneigten Leser der PEI Seiten nicht aufgefallen sein sollte, werde ich in diesem Artikel Schritt für Schritt, mit den wissens…
Strategisch gesehen hat das PEI mit seinem Brief nun auch jene Ärzte, die vorher von dem Problem der DNA-Verunreinigungen nichts wussten, auf das Problem aufmerksam gemacht, denn einen PEI Brief liest man schon eher als eine FAX-Sendung des MBV (Medizinischer Behandlungsverbund https://www.corih.de/ueber-uns.php). Nun weiß auch der letzte Wald- und Wiesenmediziner, dass es wohl ein Problem gibt.
Des Weiteren ist der Brief in normalem Deutsch und nicht in Beamtendeutsch verfasst. Ob dadurch eine menschliche Note in das Problem gebracht werden soll, ob man mit Emotionen spielen will oder einfach der Pressesprecher schon im Urlaub war oder gekündigt hat, kann ich nicht sagen.
Ich werde diesen Brief einfach auf Lügen und Widersprüche hin analysieren, wie ich das schon mit der Webseite des PEI über die Nanolipide gemacht habe und ihn wissenschaftlich mit scharfem Messer filetieren.
Die Originalaussange des PEI werde ich als Überschriften setzen. Übersetzungen und/oder Zitate in kursiver Schrift.
Das Paul-Ehrlich-Institut informiert aufgrund der Vielzahl an Anfragen aus medizinischen Fachkreisen zum aktuellen Wissenstand zu angeblichen Verunreinigungen in Impfstoffen. Diese Informationen sollen auch dazu dienen, verunsicherte Patientinnen und Patienten sowie Impfwillige aufzuklären.
Wessen Wissensstand? Den der EMA zum Beispiel? Die weiß ja, dass die Produkte mit DNA Verunreinigt sind, und dass BioNTech/Pfizer das nie in den Griff bekommen haben. Sie haben es dennoch durchgewunken.
Die EMA Dokumente kann man hier herunterladen:
Assessment Report REC 027 2021
Type II group of variations assessment report 2022
https://mega.nz/file/GIolzLDZ#Y-2dlSbF4VfA28S1mjJm_CCcn7mtTlOiHUBUO5AYhaU
Type IB variation report 16.08.2021
https://mega.nz/file/eIoSyQyS#Y2g4VtSCUlDXg9JSTY32BQIM8_Up9I8xtrkg0SMxIFw
Type IB variation report 23.09.2022
https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1252-Type-IB-variation-report.pdf
A_concerned_amyloidosis auf Twitter, hat die Highlights getwittert:
https://twitter.com/a_nineties/status/1724660618265833786
Die Schwärzungen wurden von der EMA selbst vorgenommen.
„Der MAH = marketing authorisation holder (BioNTech/Pfizer) soll Ergebnisse der Studien vorlegen, welche durchgeführt wurden, um die Stabilität des DNaseI Verdaus in der aktiven Substanz des Herstellungsprozesses zu erhöhen.“ (https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1251-Assessment-Report-for-the-Post-Authorization-Measure-REC-027.pdf Seite 4)
Das war Stand im März 2021. Alle Chargen, die davor produziert wurden hatten wohl einen nicht sonderlich stabilen DNaseI Verdau.
Warum das wichtig ist, hier mal die biologischen Basics:
Plasmid DNA dient als Kopiervorlage für die modRNA und sollte, nach der gängigen Theorie, am Ende des Herstellungsprozesses nicht mehr vorhanden sein. Wer aber einmal selbst im Labor gearbeitet hat weiß, zwischen Theorie und Praxis liegen unter Umständen Welten. Das ist auch hier der Fall. Was in der Theorie gut klang, hat sich in der Praxis als eher tückisch erwiesen.
DNA wäre ein Problem in den Produkten, weil sie bereits in nackter Form in Zellen eindringen und ins Genom integrieren kann (https://pubmed.ncbi.nlm.nih.gov/11251389/). Zudem würde es sich in diesem Fall um ein komplett anderes, selbst ebenfalls biologisch aktives Produkt als (Bei-)Produkt handeln. Statt nur modRNA, die angeblich nicht integriert und laut Moderna eine Halbwertszeit von 60h hat (https://www.judicialwatch.org/documents/jw-v-hhs-biodistribution-prod-4-02418/ S. 190), was BioNTech/Pfizer für ihr Produkt übrigens nie bestimmt haben, hätte man sehr stabile DNA, die dauerhaft ins Genom integriert. Beantragt wurde aber eine modRNA-Impfung und keine Plasmid-DNA-Impfung wie in Indien (https://www.europeanpharmaceuticalreview.com/news/160968/zycov-d-becomes-worlds-first-plasmid-dna-vaccine-for-covid-19/). Man würde also, bei nicht korrektem Entfernen der DNA-Kopiervorlagen, zwei verschiedene Produkte gleichzeitig verabreichen: eine modRNA-Impfung und eine DNA-Impfung.
DNase I ist ein Protein/Enzym, das DNA verdaut/zerstückelt und so, theoretisch, entfernen sollte. Das funktioniert aber möglicherweise nicht, weil modifizierte Bausteine für die Herstellung der modRNA verwendet werden, die „klebriger“ sind als die natürlichen Bausteine und daher kann das Enzym DNase I die Kopiervorlage nicht verdauen und so entfernen. Die detaillierte Herleitung, anhand der bekannten Literatur, warum das der Fall ist findet man hier:
https://anandamide.substack.com/p/why-is-DNasei-failing
Der entsprechende Teil, wie BioNTech/Pfizer das Problem erklären, ist in den EMA Dokumenten leider geschwärzt.
Es wurde kein detaillierter Bericht zu den begonnenen Studien, um die Stabilität des DNase Verdaus zu erhöhen, eingereicht.
[…]
Es wird erwartet, dass eine detaillierte Zusammenfassung der Ergebnisse der durchgeführten Studien zur Erhöhung der Stabilität des DNase Verdaus in Modul 3.2.S.2.5 des Dossiers bis Ende des zweiten Quartal 2021 enthalten sein wird.
[…]
PAM (Post-authorization measure) = Maßnahme nach der Zulassung: NICHT ERFÜLLT.
Bis Mitte 2021 war also definitiv ein DNA belastetes Produkt auf dem Markt und das mit Wissen und Segen der EMA. Und da Klaus Ciuchtek einmal sage „Wir sind die EMA (ca. Minute 6:47) “, wohl auch mit dem Wissen des PEI.
Daher waren die Produkte aus dem Hause BioNTech/Pfizer weder zu diesem, und wahrscheinlich auch keinem anderen Zeitpunkt, jemals GMP konform, wurden aber dennoch von staatlichen Stellen zeitgleich über Mandate massiv in den Markt gedrückt. Und das, obwohl in diesem Dokument eindeutig belegt ist, dass es sich um ein NICHT-GMP-KONFORMES Produkt handelt.
Man gab BioNTech/Pfizer daher folgende Hausaufgaben auf:
Die Empfehlung Nr. 7, die Ergebnisse der-Studien zur Verbesserung der Robustheit des DNase-Verdauungsschritts vorzulegen, wurde nur teilweise erfüllt. Es sind weitere Maßnahmen erforderlich, um die Empfehlung in Modul 2.3.5.2.5 des Dossiers bis zum Ende des zweiten Quartals 2021 zu erfüllen.
Antwort auf die Maßnahme nach der Zulassung
[...] Im Anschluss an den während der ACMF-PPQ-Kampagne beobachteten Anstieg der Rest-DNA wurden Versuche in kleinem Maßstab eingeleitet, um die Robustheit des DNase-I-Verdauungsschritts zu verbessern. Es wurden Studien durchgeführt, um die Auswirkungen von Reaktionskomponenten, Prozess- und Betriebsparametern auf die Höhe der Rest-DNA-Template besser zu verstehen. Die Studien im kleinen Maßstab sind nicht schlüssig und es werden keine Anpassungen des DNase-Schrittes empfohlen, daher werden die Daten aus diesen Studien nicht bereitgestellt.
[…]
Pfizer hat einen Aktivitätsassay für eingehende Enzyme eingeführt, um Ausreißer zu überwachen, die die Produktqualität von Arzneimitteln beeinträchtigen, bis Akzeptanzkriterien für den neuen Assay festgelegt werden können. Dies umfasst (ab hier geschwärzt).
Das Problem war aber am 29.03.2022 jedoch immer noch nicht behoben, wie man im Type 1B variation report (https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1252-Type-IB-variation-report.pdf) auf Seite 16 nachlesen kann. Die Vorgaben aus dem Jahr 2021 waren Ende März nur teilweise erfüllt. Anhand der EMA-Aktenlage ist ersichtlich, dass ein weiteres Jahr verging, man währenddessen NICHT GMP konform weiter produzierte und anschließend die geforderten Nachweise einfach schuldig blieb. Die DNA-Kontamination blieb weiterhin bestehen. Ein Beleg, dass das DNase-Verdau-Problem behoben wurde steht bis heute aus.
20/05/2021: Weitere Maßnahmen sind erforderlich, um die Empfehlung 7 zu erfüllen, einschließlich der Vorlage einer detaillierten Zusammenfassung der Ergebnisse [...]
Var IB-55: Es werden keine Ergebnisse vorgelegt, da der Antragsteller die Studie in kleinem Maßstab für nicht schlüssig hält und keine Anpassung des DNase-Verdauungsschritts empfohlen wird.
Im Klartext: Hat nicht geklappt mit dem stabileren DNase Verdau, Änderung würde nichts bringen, wir machen weiter wie bisher.
Die EMA hat das akzeptiert und die Akte am 29.03.2022 mutmaßlich einfach geschlossen, weil sie den Firmen nicht beikam und diese einfach nicht geliefert haben. An dieser Stelle hätte man das Produkt jedoch vom Markt nehmen müssen, weil der Herstellungsprozess nicht GMP konform war und ist.
(https://twitter.com/a_nineties/status/1737584727249293612)
Weiß das PEI eigentlich darüber Bescheid, dass die EMA weiß, dass es hier ein Problem gibt?
Hat das PEI diese hier verlinkten EMA Dokumente überhaupt?
Weiß das PEI, dass da drinnen steht, dass der DNase-Verdau nie funktioniert hat und man das Problem auch nie in den Griff bekommen hat?
Eine angeblichen Verunreinigungen in Impfstoffen sieht meiner Meinung nach anders aus. Das sieht mir nach einer AMTLICH/BEHÖRDLICH BELEGTEN VERUNREINIGNG in Impfstoffen aus, die man billigend in Kauf nimmt, weil der Hersteller sie nicht in den Griff bekommen hat. Ein Problem, das die komplette Plattformtechnologie betrifft. Jedes Produkt wird wieder in ein und dasselbe Problem laufen, wenn es nicht gelöst wird. Damit wäre die modRNA-Plattform aus produktionstechnischen Gründen tot.
Vielen der in der Öffentlichkeit kursierenden Daten und Untersuchungen zu mutmaßlichen Kontaminationen der COVID-19-mRNA-Impfstoffe liegen methodische Mängel zu Grunde.
An dieser Stelle fehlt leider, leider die Aufzählung der angeblichen methodischen Mängel bzw. eine Auflistung, wie man es hätte machen sollen. Was sind die Vorgaben für den Test, denen BioNTech/Pfizer selbst unterliegt? Weiß man das beim PEI?
Schauen wir doch einmal, wie das Endprodukt bei Sciensano getestet wird und die Vorstufe bei Pfizer. Ein komplettes Prüfprotokoll für eine Batch wurde über FOIA in Australien herausgeklagt und die sind wirklich aufschlussreich und können von der offizielle TGA-Seite heruntergeladen werden. Die TGA (Therapeutic Goods Administration) ist eine Abteilung des australischen Gesundheitsministeriums.
https://www.tga.gov.au/sites/default/files/foi-3390-11.pdf
Sciensano ist eine öffentliche Einrichtung, die wissenschaftliche und technische Unterstützung für die Qualität, Sicherheit und Gesundheit von Arzneimitteln und medizinischen Produkten in Belgien leistet. Sie führt auch Überwachungen, Forschungen und Gesundheitsinformationen zu verschiedenen Gesundheitsgefahren und -themen durch. https://www.sciensano.be/en
FL7649 mit einer Gesamtmenge von 683.388 Dosen wurde aus der Batch BNT162B2 Nummer 21Y513C6101 hergestellt, welche am 21.Mai 2021 bei Pfizer ACMF hergestellt wurde. Die Batch FL7649 wurde am 27. September 2021 abgefüllt.
Die RNA wurde auf verschiedene Art und Weise bestimmt:
In der modRNA Batch 21Y513C6101 wurde der modRNA-Gehalt mittels UV Spektrometrie bestimmt.
Einmal wurde vor der Verdünnung = verdünnt (3,24 mg/ml) und einmal verdünnt (2,26 mg/ml) gemessen. Der Verdünnungsfaktor ist NICHT angegeben und es kommen zwei sehr verschiedene Ergebnisse dabei heraus. Handelt es sich um eine normal notendige Verdünnung vor der Messung oder um zwei verschiedene Produktionsschritte?
Nun ist es so, dass man bei UV Spektrometrie bei 260 nm auch die DNA sehen müsste laut dem Lexikon der Medizinischen Laboratoriumsdiagnostik pp 719 (https://link.springer.com/chapter/10.1007/978-3-662-48986-4_3464):
Die extrahierte DNA zeigt bei Darstellung als Absorptionsspektrum zwischen 230 und 320 nm ein Absorptionsmaximum bei A260 (260 nm). Der Wert A280 (280 nm) wird zur Bestimmung der Reinheit der DNA und RNA gemessen und als Quotient A260/A280 dargestellt. Ein Quotient von 1,8–2,0 entspricht dabei einer reinen und sauber extrahierten DNA bzw. RNA, während Werte <1,8 oftmals auf Verunreinigungen, z. B. durch Proteine, hinweisen. Die Reinheit und sichere Konzentrationsbestimmung der DNA bzw. RNA ist für eine Mehrzahl der Applikationen unersetzlich.
Die DNA- bzw. RNA-Konzentration (c) wird berechnet nach der Formel
C [μg/mL] = A260 × Verdünnungsfaktor × Extinktionskoeffizient
Der spezifische Extinktionskoeffizient beträgt 50 für doppelsträngige DNA, 40 für einzelsträngige RNA/DNA und 20 für Oligonukleotide.
Bei 260 nm kann man aber DNA und RNA nicht unterscheiden, sie haben aber unterschiedliche Extinktionskoeffizienten. DNA einen von 50 und RNA einen von 40. DNA absorbiert bei 260 nm stärker als RNA und ist von dieser gleichzeitig nicht zu unterscheiden bei 260 nm. Der RNA-Gehalt wird also überschätzt, wenn DNA in der Lösung enthalten ist. Zudem dürfte klar sein, dass eine Methode, die DNA und RNA gar nicht unterscheiden kann, für die Bestimmung der RNA-Konzentration komplett ungeeignet ist.
An dieser Stelle frage ich mich:
DNA und RNA unterscheiden sich durch ihre Basen. DNA hat T (Thymin) und RNA hat U (Uracil). Daher wohl der unterschiedliche Extinktionskoeffizient bei der UV/VIS-Spektrometrie.
ModRNA hat aber kein U (Uracil) sondern N1-Methylpseudouridin (m1Ψ). Ändert sich dadurch der Extinktionskoeffizient? Hat man das bestimmt? Wie beeinflusst das die Konzentrationsbestimmung?
Ich bin nicht die Erste, die sich diese Frage stellt, andere waren ein wenig schneller.
“Wir berichten, dass N1-Methylpseudouridin bei 260 nm ca. 40 % weniger UV-Licht absorbiert als Uridin, und dass sein Einbau in mRNAs zu einer Unterschätzung der nukleosidmodifizierten mRNA-Konzentrationen führt, mit einem Fehler von 5-15 %, und zwar in Abhängigkeit von der mRNA-Sequenz.” (biorxiv.org/content/10.1101/2023.07.27.550903v2.full.pdf )
DAS klingt mir schwer nach einer potentiellen (zusätzlichen) Überdosierung, wenn man den Extinktionskoeffizienten bei BioNTech/Pfizer “vergessen” hat experimentell zu bestimmen.
Ich hinke mit meiner Erkenntnis Kevin McKernan nur einen Monat hinterher:
Der 280 nm Wert wäre für die Reinheit des Produktes wichtig, um sicherzustellen, dass keine bakteriellen Proteine aus der zellfreien Kultur in der modRNA-Lösung enthalten sind. Das hat man leider nicht gemacht. Auch fehlen SDS-Gele, die überprüfen, ob das Produkt frei von bakteriellen Proteinen ist.
Das Produkt vor Verdünnung und Formulierung darf laut EMA mit DNA kontaminiert sein bis 300µg DNA pro ml unverdünntem aktiven modRNA-Produkt. Wieviel DNA hat Prof. Dr. König gemessen?
https://twitter.com/a_nineties/status/1740476944498761932/photo/1 aus Rapporteur's Rolling Review Report Quality - COVID-19 mRNA Vaccine BioNTec S. 30
Die DNA wird dann aber mit qPCR gemessen, was ein anderes Verfahren ist und dessen Ergebnisse somit nicht wirklich denen der Spektrometrie entsprechen und sich somit NICHT zur Quotientenbildung eignen. Man vergleicht Äpfel mit Birnen. Beides sind Rosengewächse, aber dennoch sehr unterschiedliche Früchte.
Zudem hat qPCR so ihre Tücken durch die DNA:RNA-Hybridbildung und die G-Quadruplexe. Dazu haben Patent Sun und a nineties reads und Anandamide mehr auf ihren Substacks, daher spare ich mir die Details an dieser Stelle.
Bei rtPCR wäre es aber möglich gewesen den RNA- und DNA- Gehalt mit der gleichen Methode, nur mit jeweils anderer Polymerase zu messen, und so einen sauberen Quotienten mit gleicher Messmethodik zu bilden. Das wird aber bewusst vermieden.
Stattdessen vergleicht man nun Ergebnisse zweier komplett unterschiedlicher Messmethoden. Die eine überschätzt die Menge an RNA, weil sie diese nicht von DNA unterscheiden kann, die andere unterschätzt die Menge an DNA. Damit optimiert man sein Ergebnis auf Seiten von Pfizer.
Anschließend wurde das Endprodukt, die Charge FL7649 bei Sciensano gemessen.
Sciensano verwendet erneut eine andere Messmethode, diesmal Fluorometrie (die im Übrigen auch von Frau Prof. Dr. König und dem MMD-Labor Magdeburg (https://www.mmd-web.de/) verwendet wurde).
Wenn Sciensano Fluorometrie im Auftrag der Firmen verwendet, warum darf Frau Dr. Prof. König das dann nicht?! Muss doch die validierte Methode sein, sonst hätte Sciensano das doch nie so gemacht.
Aus den FDA Daten wissen wir, dass höchstwahrscheinlich der Fluoreszenzfarbstoff Ribogreen verwendet wurde (https://pdata0916.s3.us-east-2.amazonaws.com/pdocs/110122/125742_S1_M4_20256434.pdf#page=181, https://pdata0916.s3.us-east-2.amazonaws.com/pdocs/110122/125742_S1_M4_20256434.pdf#page=183, https://pdata0916.s3.us-east-2.amazonaws.com/pdocs/110122/125742_S1_M4_20256434.pdf#page=185).
SYBR für SYBR Green brachte im Abstractor, der Dokumentensuchmaschine von DailyClout (https://vaccines.shinyapps.io/abstractor/) keine Treffer genauso wenig wie PicoGreen.
Der Haken ist, dass PicoGreen selektiver auf RNA/DNA Hybride reagiert als RiboGreen, welche eigentlich DNA besser bindet als RNA. Die Details und die entsprechende Literatur, das zu belegen, kann man hier nachlesen:
Mit jeder DNA-Kontamination, erhält Pfizer bzw. Sciensano so 2x mehr "RNA"-Signal.
Pfizer hätte also PicoGreen verwenden müssen statt RiboGreen bzw. wenn sie wirklich korrekt hätten messen wollen qPCR für DNA und RNA. Das hätte auch Sciensano machen müssen/können.
Man hat die Methode also für ein kosmetisch besseres Ergebnis optimiert.
Ehrlicher Weise kann ich aber auch nicht sagen, welchen Farbstoff MMD genommen hat und ob sie ganze Spektren aufgenommen haben. DNA und RNA Farbstoffe wären ein eigener Substack, dem sich einmal ein Spezialist widmen müsste.
Ich kann nur eine 6-seitige Übersicht als Link bieten.
LjPr-21-06.pdf (laborjournal.de)
bzw. einen Übersichtsartikel zu dsDNA-Farbstoffen: Gel-Stains-Comparison.pdf (biotium.com)
Bei Farbstoffen für qPCR und dergleichen bin ich persönlich raus. Das war alles schon nach meiner aktiven Laborzeit. Ich habe noch mit EtBr gearbeitet, meine DNA und Protein UV/Vis-Spektren aufgenommen und meinen Konzentrationen noch per Taschenrechner berechnet.
Wer zu den Farbstoffen einen Artikel schreiben will und hier als Gastautor veröffentlichen will, ist herzlich willkommen.
Wie auch immer, es gibt eine Publikation, gefördert von der “Bill und Melinda Gates Foundation”, die beschreibt, wie man das nach USP hätte korrekt machen müssen, obwohl auch da keine Grenzwerte/Akzeptanzkriterien genannt werden.
https://pubmed.ncbi.nlm.nih.gov/36351479/ und https://www.usp.org/mrna
Exakt das, was Kevin und anderes sagen: modRNA mit RT-qPCRund DNA mit qPCR messen, damit man nicht Äpfel mit Birnen vergleicht.
Auch stellt sich das Problem der möglicherweise unsachgemäßen Lagerung der untersuchten Impfstoffdosen. Experimentelle Bestimmungen z. B. von Rest-DNA durch Dritte in auf dem Markt verfügbaren Impfstoffdosen müssen folgende Kriterien erfüllen, um wissenschaftlich haltbare Ergebnisse zu erbringen: (i) Sie dürfen nicht an Proben erfolgen, die aus abgelaufenen (Haltbarkeitsdatum überschritten) Impfstoff-Fläschchen oder aus angebrochenen oder nicht sachgemäß gelagerten Impfstoff-Fläschchen stammen.
Aber verimpft werden durften abgelaufene Impfdosen schon. Da hat man dann einfach das Ablaufdatum verlängert (https://www.pei.de/DE/newsroom/hp-meldungen/2022/220421-covid-19-impfstoff-comirnaty-haltbarkeitsdauer-auf-12-monate-verlaengert.html).
Warum darf man dann nicht auch gefrorene Impfstoffe, die abgelaufen sind untersuchen?
Zumal, es kommt auf die Untersuchung an. Ja, Transfektionsstudien (also ob das Produkt noch in Zellkultur funktioniert), wäre in dem Fall wahrscheinlich hinfällig, ABER die Inhaltsstoffe an sich, sind noch zum Großteil unverändert vorhanden.
DNA ist extrem stabil, sonst gäbe es nicht den Fachbereich der Paleogenetik (https://de.wikipedia.org/wiki/Pal%C3%A4ogenetik) oder Rechtsmedizinische DNA-Gutachten. Die DNA pro Volumen bliebe konstant, auch wenn die (angeblich doch so stabile modRNA) bereits komplett zerfallen wäre.
Die kationischen Lipide könnte man auch bei zerfallenen LNPs immer noch im Massenspektrometer messen, weil sie bei der Messung ohnehin zerfallen.
Eine Untersuchung auf langlebige Bestandteile ist also auch in abgelaufenen Proben problemlos möglich, das gilt übrigens auch für Endotoxine, die sind auch extrem langlebig und stabil.
Das vom PEI genannte Problem mit den nicht korrekt gelagerten Proben ließe sich durch die Bundesregierung sehr einfach lösen:
Forscher bekommen einfach ein paar Fläschchen aus den Bundesbeständen, die ohnehin aktuell kaum einer mehr will. Warum bietet man das nicht an?
(ii) Die angewandte Methodik zur Bestimmung der Rest-DNA-Menge muss nachgewiesenermaßen geeignet und nachvollziehbar sein – insbesondere sollten Testinterferenzen durch das Vorhandensein von Lipid-Nanopartikeln in den Impfstoff-Fläschchen ausgeschlossen worden sein (was bei Testung am finalen Impfstoff-Fläschchen nicht garantiert werden kann).
Frau Prof. Dr. König verwendet scheints die gleiche Messmethode wie Sciensano, das im Auftrag der Hersteller oder von wem auch immer misst. Die Methode muss also nachgewiesenermaßen geeignet und nachvollziehbar sein. Träfe eine Interferenz mit den LNP zu, dürfte auch Sciensano das Verfahren so nicht einsetzen.
(iii) Die angewandte Methode muss validiert worden sein, um verlässliche und überprüfbare Ergebnisse zu liefern.
Frau Dr. König verwendet scheint es die gleiche Messmethode wie Sciensano, das im Auftrag der Hersteller oder von wem auch immer misst. Die Methode muss also muss validiert worden sein. Träfe eine Interferenz mit den LNP zu, dürfte auch Sciensano das Verfahren so nicht einsetzen.
In den häufig zitierten Preprint-Veröffentlichungen von McKernan et al. (April 2023) und Speicher et al. (Oktober 2023) fehlen ausreichende Angaben, ob die genannten Bedingungen eingehalten wurden, sowie Angaben zur Nachvollziehbarkeit der gewählten Methodik. Eine Methoden-Validierung ist unerlässlich, um sicherzustellen, dass mit der Durchführung der eingesetzten Methode zu jedem Zeitpunkt und unabhängig von der ausführenden Person verlässliche und reproduzierbare Ergebnisse erzielt werden und dass die Methode für ihren Einsatzzweck geeignet ist. Die o. g. Bedingungen für den Erhalt wissenschaftlich haltbarer Messergebnisse bei der Rest-DNA-Bestimmung werden von den Herstellern eingehalten.
Die Methoden wurden von Pfizer selbst auch eingesetzt wie oben demonstriert wurde. Wenn Pfizer diese Methoden selbst nutzt, wenn auch so „optimiert“ dass die Ergebnisse in ihrem Sinne verbessert werden, müssen sie ergo validiert sein.
Es ist nicht die Schuld der Wissenschaftler, wenn man ihnen keine offiziellen Proben zur Verfügung stellt, dem könnte das PEI oder die FDA durch Herausgabe von Bundesvorräten sofort abhelfen.
Für die Herstellung der COVID-19-mRNA-Impfstoffe dient ein Teil der PlasmidDNA als Matrize (Template). Nach dem Umschreiben der relevanten DNasequenz in mRNA wird die Plasmid-DNA dann mittels eines enzymatischen Verdaus mit DNase zerkleinert und über den Aufreinigungsprozess unter Erhalt der aktiven Substanz (mRNA) abgereichert. Eine Plasmid-DNA-Restmenge ist aber in kleinen, als unschädlich geltenden Mengen unterhalb eines in der Zulassung festgelegten Grenzwerts vorhanden.
Diese Aussage ist immer noch falsch.
Ich muss mich in diesem Substack leider mehrfach wiederholen.
Der DNase Verdau hat nicht funktioniert, das weiß die EMA. Siehe oben im Text.
Und nein, DNA-Reste sind nicht harmlos, das hat Klaus Cichutek, der ehemalige PEI Chef, bereits 1994 und 2000 veröffentlich. Das kann man im Detail hier nachlesen:
Wie man sich aus seinen eigenen Worten einen Strick dreht weiß der Klausi
Mein Freund sagt immer: „Wenn es so weit ist, will ich einfach nur am Straßenrand sitzen, Hanfseile flechten und den frisch aufgewachten Geschlumpften zuarbeiten.“ So wie ich das im Falle von Klausi Cichutek sehe, hat der sich sein Seil mit Worten bereits vor 29 Jahren selbst geknüpft.
Wie man sich aus seinen eigenen Worten einen Strick dreht weiß der Klausi Teil 2
Nachdem Klaus Cichuteks Publikation von 1994 endlich die Aufmerksamkeit erhält, die ihr gebührt, und er seinen Hut genommen hat, nachdem der MBV ihn aufs Korn genommen hatte, https://t345034af.emailsys1a.net/mailing/206/7170057/2276824/148426/639fc2b5ee/index.html
Bis dato gibt es keine Anhaltspunkte dafür, dass Nebenwirkungen in Verbindung mit DNA-Restmengen in den zugelassenen COVID-19-mRNA-Impfstoffen in Verbindung stehen könnten
“Extrazelluläre Desoxyribonukleinsäure (DNS) war ein bisher unerkannter zellulärer Bestandteil des Blutes, der tiefgreifende proinflammatorische und prothrombotische Wirkungen hervorruft.” (https://www.frontiersin.org/articles/10.3389/fimmu.2020.568513/full)
Mehr braucht man eigentlich zu diesem Paper nicht mehr sagen. Die Überschrift und dieser eine Satz sagen bereits alles. Wenn freie DNA im Blut ist, führt das zu einer Entzündung und kann eine Thrombose hervorrufen. Wenn also, nicht verpackte, nachte dsDNA in einer Injektion vorhanden ist, kann die nackte DNA, weil sie ins Blut geraten ist, bereits eine Thrombose auslösen.
Ich liebe es, wenn Paper eindeutig sind und man sie einfach direkt zitieren kann. Mehr ist zu diesem Thema nicht zu sagen, schätze ich.
“Extrazelluläre DNA kann direkt die Fibrinbildung induzieren und dadurch das Thrombuswachstum fördern.”
Dazu kommen noch auf alle Nebenwirkungen, die Klaus Cichutek, der ehemalige PEI Chef, 1994 uns 2000 vorhergesagt hat, siehe oben.
Zudem gilt meines Wissens immer noch das Vorsorgeprinzip (https://de.wikipedia.org/wiki/Vorsorgeprinzip)
Das Paul-Ehrlich-Institut weist explizit darauf hin, dass bei der Herstellung von COVID-19-mRNA-Impfstoffen keine DNA aus Zellen tierischen Ursprungs eingesetzt werden. Es handelt sich ausschließlich um Plasmid-DNA bakteriellen Ursprungs.
Das ist korrekt.
Mögliche Risikoaspekte, die bei Rest-DNA aus Zellen tierischen Ursprungs entstehen könnten, sind eine potenzielle Tumorigenität durch Übertragung von Vorläufer-Onkogene (Proto-Onkogene) und eine potenzielle Infektiosität der DNA durch Übertragung vollständiger funktioneller viraler Gene. Diese sind für DNA bakteriellen Ursprungs nicht gegeben.
Leider doch. Plasmide und lineare DNA integrieren übrigens ganz wunderbar in Zellen, besonders, wenn sie Liposomen verpackt sind und SV40 Promotoren enthalten.
(https://doi.org/10.1002/0471266949.bmc073.pub3)
Das steht sogar im Thermofischer Katalog.
„Obwohl zirkuläre DNA für die transiente Transfektion bevorzugt wird, sind lineare DNA-Vektoren für die Durchführung stabiler Transfektionen effizienter. Dies liegt an der besseren Fähigkeit der linearen DNA, sich in das Wirtsgenom zu integrieren. Obwohl lineare DNA von den Zellen weniger effizient aufgenommen wird, ist lineare DNA mit freien Enden rekombinanter und wird mit größerer Wahrscheinlichkeit in das Wirtschromosom integriert, um stabile Transformanten zu erzeugen.“ https://thermofisher.com/au/en/home/references/gibco-cell-culture-basics/transfection-basics/applications/plasmid-transfection.html
Im Übrigen integrieren auch ganz kleine Fragmente (https://www.jbc.org/article/S0021-9258(18)31087-1/fulltext)
Und der Ex-Chef des PEI wusste das 2000 auch bereits. Das Paper habe ich schon mehrfach in diesem Artikel angesprochen.
Und ja, die EMA hat zugegeben, dass der SV40 Promotor enthalten ist, darüber gibt es auch nichts mehr zu diskutieren. Die EMA gibt sogar zu, dass Pfizer den Promotor in der Plasmidkarte unterschlagen hat. SV40 ist ein alter Promotor, der in allen Annotationsbibliotheken standardmäßig enthalten ist. Pfizer muss diesen also händisch aus der Annotationsbibliothek gelöscht haben.
(https://twitter.com/BerryTartlet/status/1716877124496470492 und https://t.me/RA_Roehrig/6646)
Das interessante an dieser EMA-Mail: DIE LÜGEN!!! NACHWEISLICH!!!
Die DNA ist nicht “broken down and removed” und das wussten sie zu diesem Zeitpunkt auch, weil sie ja die entsprechenden, oben erklärten Dokumente, erstellt hatten.
Was auch immer nun das Problem ist, die Diskussion ist eigentlich ohnehin beendet seit diesem Paper:
Dhuli K, Medori MC, Micheletti C, Donato K, Fioretti F, Calzoni A, Praderio A, De Angelis MG, Arabia G, Cristoni S, Nodari S, Bertelli M. Presence of viral spike protein and vaccinal spike protein in the blood serum of patients with long-COVID syndrome. Eur Rev Med Pharmacol Sci. 2023 Dec;27(6 Suppl):13-19. doi: 10.26355/eurrev_202312_34685. PMID: 38112944. https://pubmed.ncbi.nlm.nih.gov/38112944/
Man hat das Blut von 81 Patienten mit Long-Covid gesammelt, die genomische DNA extrahiert und dann eine BNT162b2 spezifische PCR gemacht… Die war positiv.
Man geht in diesem Paper leider direkt davon aus, dass es sich um revers-transkribierte modRNA handelt (also modRNA, die über Line-1 in DNA umgeschrieben wurde) und hat nicht auf Plasmidinsertion mittels PCR auf SV40 getestet. Damit ist die Frage leider nicht geklärt, ob die Verunreinigung insertiert oder eine revers-transkribiertes Produkt der modRNA. ABER es sind in vivo Daten und irgendwas insertiert. Was genau, ist eine akademische Frage, die den Patienten nicht weiter hilft, das Problem wäre das gleiche: dauerhafte oder zumindest potentiell jahrelange Spike-Produktion bei etwa der Hälfte der Behandelten (https://onlinelibrary.wiley.com/doi/epdf/10.1002/prca.202300048).
Und ja, methodisch kann man das Paper durchaus diskutieren und muss die Daten überprüfen.
Insertion des BioNTech/Pfizer Produktes abzustreiten, wenn sie jedoch bereits in Patienten nachgewiesen wurde, und peer reviewed veröffentlich ist, ist schon mehr als dreist.
Ganz abgesehen davon, dass der SV40 Promotor laut “Allgemeine Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentechnische Arbeiten mit SV40 als Spenderorganismus” (https://www.bvl.bund.de/SharedDocs/Downloads/06_Gentechnik/ZKBS/01_Allgemeine_Stellungnahmen_deutsch/11_Stellungnahmen_Vergleichbarkeit/SV_40.pdf%3F__blob%3DpublicationFile%26v%3D2) in die Risikogruppe 2 gehört:
Vor diesem Hintergrund finden die WHO-Guideline „Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks” und die Guideline der US-amerikanischen FDA “Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications“ keine Anwendung bei der Herstellung der mRNA-Impfstoffe. Denn beide Guidelines beziehen sich explizit auf Zellen tierischen Ursprungs, nicht auf bakterielle Zellsubstrate. Bakterielle Zellen sind von den Guidelines ausdrücklich ausgenommen.
Warum wird hier die WHO Guideline erwähnt und nicht die Pharmacopeia Europeana? Das BioNTech/Pfizer Produkt ist doch juristisch eine klassische Impfung. Dementsprechend müssten auch die Grenzwerte für klassische Impfungen wie HPV oder Hepatitis gelten, will man wirklich konsequent sein. Und diese Grenzwerte sind SEHR niedrig:
(https://twitter.com/a_nineties/status/1743374228127097207 und https://www.edqm.eu/documents/52006/277487/Free+access+to+supportive+pharmacopoeial+texts+in+the+field+of+vaccines+for+human+use+during+the+coronavirus+disease+%28COVID-19%29+pandemic+Updated+package+-+October+2020.pdf/72875b16-432e-3854-36ca-51422e221d68?t=1637742526915)
ganz abgesehen davon, dass das wohl auch schon seit Jahren gängiger Industriestandard ist, von dem BioNTech/Pfizer wohl keine Ahnung haben will, genau wie das PEI, das sich auf Grenzwerte zurückzieht, die es nicht referenziert, nicht belegt und auch nicht herleitet, warum diese Grenzwerte gelten sollen, statt jene traditioneller Impfstoffe.
(https://twitter.com/a_nineties/status/1743023543783247920 und https://t.co/oYKR9TsWfe)
Im obigen Bild haben wir übrigens die vom PEI nicht referenzierte WHO Richtlinie von 1987!!! mit 100pg/Dosis. Technisch möglich ist 10 pg/Dosis, zumindest laut diesem Merck Poster. Merck ist BioNTech Zulieferer für LNPs. Filter hätten die sicherlich auch im Angebot gehabt, wenn BioNTech/Pfizer gewollt hätten.
Aber hier spielen PEI und BioNTech/Pfizer wohl ein Hütchenspiel: Die Grenzwerte gelten nicht, weil es um E.Coli Kultur geht und nicht um tierische Zellkultur. ABER bakterielle CpG Motive sind möglicherweise ein größeres Problem, weil sie nicht methyliert sind wie tierische CpG Motive. Müssten da nicht sogar noch strengere Grenzwerte gelten?
Die FDA Empfehlung liegt bei 10ng und unter 200 Basenpaaren.
Über die Länge der der Fragmente der DNA-Verunreinigungen haben wir noch gar nicht zu diskutieren begonnen, liebes PEI. DAS kommt noch.
Der Haken jedoch ist: ES GIBT KEINE GRENZWERTE! Nicht einmal die WHO hat die Hersteller dazu bewegen können, sich auf Akzeptanzkriterien festzulegen: The Storage and In-Use Stability of mRNA Vaccines and Therapeutics: Not A Cold Case - PubMed (nih.gov)
Die Hersteller haben das Problem der Grenzwerte/Akzeptanzkriterien vermieden wieder Teufel das Weihwasser.
Die EU hat zumindest eine Kommission eingesetzt: Ph. Eur. Commission establishes a new working party on mRNA vaccines - European Directorate for the Quality of Medicines & HealthCare (edqm.eu)
Daher eiern alle Behörden so um die Grenzwerte herum: ES GIBT KEINE GRENZWERTE, weil die Hersteller keine Lust auf Grenzwerte hatten, weil sie wissen, dass ihre Brühe dreckig ist!
Unabhängig davon gilt das regulatorische Prinzip, dass so wenige Verunreinigungen wie möglich in einem Impfstoff vorliegen und selbst theoretische Risiken soweit wie möglich reduziert werden sollten. Daher wurden für die zugelassenen COVID-19-mRNA-Impfstoffe sehr konservative Grenzwerte für Rest-DNA angesetzt, die nicht überschritten werden dürfen.
Wie wurden diese Grenzwerte bestimmt? Was ist die wissenschaftliche Grundlage dieser Grenzwerte? Wo stehen die Experimente, mit denen das bestimmt wurde, also die wissenschaftlichen Publikationen, damit ich das nachlesen kann? Hier fehlt mir eindeutig eine Quelle bzw. mehrere Quellen. Ohne Quellen ist das eine reine Behauptung. Bitte senden Sie mir ihre Quellen bzw. Protokolle der Absprachen zu. Danke im Voraus für ihre Mitarbeit.
Ganz nebenbei, kleine Erinnerung an Eure eigenen Grundsätze:
Was ist so schwierig daran, die entsprechenden Dokumente zu verlinken, oder eine Endnote zu setzen? Ich verlange ja nicht einmal MLA oder ein anderes Zitierungssystem, mir reichen schon Links. Es gibt kostenlose Zitierprogramme wie Mendeley oder Zotero. Die Verwendung lernt man mittlerweile im ersten Semester.
Vielleicht hat man keine Dokumente verlinkt, weil es sich um eine glatte Lüge handelt?
Die Swissmedic hat nämlich wie folgt geantwortet:
“Für DNA-Verunreinigungen in mRNA-Impfstoffen gibt es weder in der Schweiz noch in anderen Ländern einen definierten Grenzwert.”
Im Laufe des Herstellungsprozesses wird sowohl auf genomische Rest-DNA aus Bakterien als auch auf Rest-Plasmid-DNA getestet. Die Fragmentierung der Plasmid-DNA mittels DNase-Behandlung der mRNA, wie sie in den zugelassenen COVID-19- mRNA-Impfstoffprodukten gegeben ist, sorgt für eine zusätzliche Sicherheit, denn selbst wenn vollständige und funktionelle Gene enthalten wären, würden diese durch den DNase-Verdau bei der Herstellung nahezu vollständig abgebaut und dadurch unschädlich gemacht.
Aber nur, wenn der funktionieren würde, was er laut den EMA-Dokumenten eben nicht tut. Dieses Argument ist somit hinfällig. Bitte fragen sie bei der EMA nach, warum die das durchgewunken hat! DAS wäre dem PEI aufgefallen, hätte es selbst (im Schichtdienst) getestet.
Es gibt dazu ein altes Sprichwort: Trau, schau, wem.
Denn kleine DNA-Fragmente werden als unschädlich betrachtet, da sie nicht für funktionelle Proteine codieren können (FDA Guidance for Industry (2010): “Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications”).
Moderna sieht das übrigens anders als das PEI, da kursieren aktuell gerade zwei schöne Poster auf Twitter, die den Standpunkt von Moderna sehr schön zusammenfassen:
https://twitter.com/Patent_SUN/status/1747644965990359530
In der Bancel Sprechblase steht eigentlich alles drinnen:
“Während des mRNA Produktionsprozesses verbleiben DNA-Fragmente. Rest DNA kann Krebs erzeugen. Man muss die Rest-DNA quantifizieren. ABER qPCR kann kleine DNA Bruchstücke nicht messen, schon aufgrund ihrer Funktionsweise. Daher müssen wir eine andere Methode verwenden, um die kleinen DNA-Fragmente zu quantifizieren.”
Link zum Patent: US10077439B2 - Removal of DNA fragments in mRNA production process - Google Patents
Warum muss man das tun?
Weil auch ganz kleine Fragmente integrieren (https://www.jbc.org/article/S0021-9258(18)31087-1/fulltext) und das weiß man SPÄTESTENS seit Januar 2000.
Das Zauberwort in diesem Abschnitt des PEI Briefes ist „betrachtet“. Man postuliert die Unschädlichkeit ohne entsprechende Beweise vorzulegen, weil keine Proteine hergestellt werden.
Nun ist es aber so, insertieren können diese Fragmente immer noch, damit haben wir es mit Insertionsmutagenese zu tun. Diese kann zu Krebs führen und das kann man in Klaus Cichuteks Publikationen aus dem Jahr 1994 und 2000 auch so nachlesen. Unschädlich ist das nicht, selbst wenn keine Proteine gebildet werden.
Von Antisense-Oligonucleotiden (https://de.wikipedia.org/wiki/Antisense-Oligonukleotid) fange ich hier gar nicht erst an, das ginge zu sehr ins Detail. Die müssen nicht einmal insertieren, um Schaden anzurichten. Die Grundlagen dazu stehen sogar in der Wikipedia, so bekannt ist das.
Die Details kann man hier nachlesen:
Integriert die Plörre nun oder nicht?
Die Diskussion, ob die Plörre nun in das Genom integriert oder nicht, ist ja immer noch eine heiße Frage, weil, mir zumindest, noch kein endgültiger Laborbeweis mittels Sequenzierung, der das Plasmid oder Teile davon in einem Tumor nachweist, bekannt ist.
Die Testung auf Rest-DNA ist nicht Teil der offiziellen experimentellen OMCLTestung (Official Medicines Control Laboratory) zur Chargenfreigabe.
Und warum nicht? Hätte man das nicht testen sollen? Gibt man hier zu, dass man nicht getestet hat und somit eigentlich gar nicht mit Sicherheit sagen kann, dass die „Gerüchte“ falsch sind?
Welche Geräte dem PEI zur Verfügung stehen, kann man hier erahnen:
Ja, CD-Spektrometrie und Massenspektrometrie scheint das PEI nicht zu können, aber das die gängigen Geräte wie Photometer (UV/VIS), HPLC, Western Blot, ELISA, Fluoreszenzmessung, pH-Meter, Gaschromatograph, Gelelektrophorese, Kapillarelektrophorese, Laserdiffraktometer, Refraktometer, Mikroskop (Lichtmikroskop, Fluoreszenzmikroskop), (q)PCR-Cycler … scheint vorhanden zu sein. Diese kommen aber scheint’s nicht zum Einsatz bei den Covid-”Impfstoffen”, nur bei anderen Impfstoffen. Dabei wären Fluoreszenzmessung, qPCR und Photometer vorhanden, um die Gerüchte ganz schnell und einfach aus der Welt zu schaffen. Nur am Willen mangelt es wohl. Oder will man vielleicht nicht mit einer Substanz der Gefahrenstufe OEB 5 (https://phmpt.org/wp-content/uploads/2023/11/125742_S11_M3_32r_pf-07302048-dp-rm-coa.pdf) arbeiten?
Das PEI ist nach seiner eigenen Aussage nach DIN EN ISO 9001 zertifiziert, hat sich also an diese DIN Norm zu halten (https://www.pei.de/SharedDocs/Downloads/DE/regulation/qm/broschuere-qualitaetsmanagement.pdf?__blob=publicationFile&v=6)
Zu dieser Norm gehört ein SPC – statistical process control.
Diese Norm umfasst die Benennung desjenigen, der für die Chargenfreigabe zuständig ist. Das wäre im Falle des PEI Herr Dr. Volker Öppling (https://www.edqm.eu/en/d/268638):
Wenn es bei einer Charge trotz Freigabe tatsächlich zu Problemen kommt, trägt diese Person die Verantwortung?
Vielleicht sollte man einmal direkt bei Herrn Öppling nachfragen, der müsste bestens Bescheid wissen.
Alternativ könnte man auch Dr. Hanna Sediri-Schön fragen, deren Name auf diesem PEI Batch Release Dokument zu finden ist.
(https://twitter.com/ReportAdve30828/status/1714621396670611966/photo/1)
(https://www.linkedin.com/in/hanna-sediri-sch%C3%B6n-29223396/)
Dr. Sediri-Schön hat auch Artikel wie diesen verfasst:
Sediri-Schön H, Lange J, Grabski E, Wagner R, Hildt E. Chargenprüfung als wesentliche Säule der Versorgung mit sicheren und wirksamen Impfstoffen [Batch testing as an essential pillar of the supply of safe and effective vaccines]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2022 Dec;65(12):1244-1250. German. doi: 10.1007/s00103-022-03611-1. Epub 2022 Oct 20. PMID: 36264321; PMCID: PMC9582401. https://link.springer.com/article/10.1007/s00103-022-03611-1
In diesem Paper finden sich interessante Passagen
ISO 17025: https://www.iso.org/ISO-IEC-17025-testing-and-calibration-laboratories.html
Schauen wir doch einmal, was sich hinter dem Wörtchen Integritätsprüfung, die vom PEI hätte durchgeführt werden müssen auch OCABR, verbirgt (https://www.edqm.eu/en/omcl/ocabr-activities-related-to-covid-19-vaccines).
Laut Sediri-Schöns oben gelisteter Publikation, wurde deswegen im PEI sogar Schichtdienst eingeführt (für die angeblich nur durchgeführt Sichtkontrolle).
Diese Publikation widerspricht der Stellungnahme des PEI gegenüber der MDR Umschau:
Was hat das PEI als OMCL oder zumindest das beauftragte OMCL (OMCL steht übrigens für Official Medicines Control Laboratory, also Amtliches Arzneimittelkontrolllabor) laut OCABR alles testen müssen bezüglich Integrität?
Da findet man z. Bsp.:
3.2.2.1 mRNA
Erscheinungsbild, Identität der kodierten RNA, Gehalt (RNA-Konzentration), RNA-Integrität / Reinheit, RNA-Verunreinigungen (falls zutreffend), 5' Cap, Poly(A)-Schwanz, Reste der DNA-Vorlage, Reste von dsRNA (falls zutreffend), Reste von Lösungsmitteln (falls zutreffend), pH-Wert, Endotoxin-Gehalt, Biologische Belastung (Bioburden)
3.2.2.2 LNP (falls zutreffend)
Erscheinungsbild, Identität der einzelnen LNP-Bestandteile, Gehalt der einzelnen LNP-Bestandteile, LNP-Verunreinigungen, LNP-Größe, LNP-Polydispersität, pH-Wert, Osmolalität, Reste von Lösungsmitteln, Endotoxin-Gehalt, Bioburden
3.2.2.4 Endgültiger Bulk-Impfstoff (falls zutreffend)
Erscheinungsbild, Erscheinungsbild (sichtbare Partikel), Erscheinungsbild (nicht sichtbare Partikel), pH-Wert, Osmolalität, LNP-Größe, LNP-Polydispersität, RNA-Verkapselung, RNA-Gehalt, Gehalt an LNP-Komponenten für jede LNP-Verunreinigungen (falls zutreffend), Identität der LNP-Komponenten für jedes Extrahierbares Volumen, Identität der RNA-kodierten Sequenz, In-vitro-Expression, RNA-Integrität / -Reinheit, RNA-Verunreinigungen (falls zutreffend), Rückstände von Lösungsmitteln (falls zutreffend), Endotoxin-Gehalt, Sterilitätstest
Experimentelle OMCL-Testungen von Proben jeder Charge von zugelassenen Impfstoffen umfassen die auf Grundlage der Bewertung der Impfstoffe im Zulassungsprozess als relevant identifizierten produktspezifischen LaborWirksamkeits (Potency)- und -Sicherheitsparameter.
Und DNA war beim amtlichen Arzneimittelkontrolllabor PEI eben nicht relevant?
Im Übrigen hat man auch vergessen den Zeta Wert zu bestimmen, der bei -3,13 mV liegen muss laut Hersteller, sonst verteilt sich das Produkt laut EMA Dokument, ladungsgetrieben auf ungewünschte Art und Weise im ganzen Körper.
Positive LNP gehen in die Lunge
Neutrale LNP (ca. -3mV) gehen in die Leber und andere Bereiche des Körpers
Negative LNP gehen in die Milz
BioNTech/Pfizer wollte mit -3,13 mV hauptsächlich neutrale LNPs liefern, die in die Leber und andere Bereiche des Körpers gehen (https://pubmed.ncbi.nlm.nih.gov/27281205/), daher hätte man die Ladung/das Zetapotential/den Zetawert bestimmen müssen. Dann wäre einem aufgefallen, dass die Aussage von BioNTech/Pfizer der Aussage, das Produkt bleibt im Muskel oder geht in die Dendritischen Zellen, widerspricht. ABER man hat sich entschieden, das Zetapotential einfach zu ignorieren, und nicht zu testen.
Eine DNA Verunreinigung hätte Zeta negativer werden lassen, auch damit wäre eine Verunreinigung aufgefallen. Zeta ist wichtig, um unspezifisches Binden in den Blutgefäßen zu vermeiden (was passiert ist, sonst könnte man in dort keine Spikes in den Zellen der Gefäßwände nachweisen).
Seltsamerweise hat BioNTech am Anfang Zeta bestimmt. Warum später nicht mehr und warum hat das PEI nicht darauf bestanden?
Zumal der Wert in den Dokumenten durchaus mit den entsprechenden Messmethoden benannt wird und teilweise auch bestimmt wurde:
(Annex 1 - Draft 3.2.P.2.2 Drug Product.pdf - Google Drive Seite 30)
(Annex 1 - Draft 3.2.P.2.2 Drug Product.pdf - Google Drive Seite 38)
Und wo wir schon bei nicht gemachten Messungen sind, da wäre noch die Länge der PEG-Schwänze des ALC-0159, die man nicht per Massenspektrometrie geprüft hat, obwohl man bei BioNTech/Pfizer und somit sicherlich auch beim PEI, sehr genau wusste, dass die einen Einfluss auf die Nebenwirkungsrate und das Targeting hat.
Rapporteur's Rolling Review Report Quality - COVID-19 mRNA Vaccine BioNTec S. 160.
„Tarnende Lipide wie PEG-Lipide sind für eine längere Halbwertszeit und Stabilität der LNP-Partikel erforderlich und beeinflussen ihre physikochemischen Eigenschaften. Nach der Verabreichung von LNP-mRNA in das Blut adsorbiert das LNP auf seiner Oberfläche zahlreiche Proteine und bildet eine "Proteinkorona"“.
"Daher muss der Grad der PEG-Abschirmung optimiert werden, um einen Kompromiss zwischen Wirksamkeit und Sicherheit zu erreichen.“
"Die Autoren fanden heraus, dass die Verwendung der kurzen PEG-Alkylkette nach intramuskulärer Verabreichung bei Mäusen zu einem deutlich verbesserten Lymphknoten-Targeting führte."
“die Autoren fanden weniger gebildete Anti-PEG-Antikörper und eine erhebliche Verringerung der Nebenwirkungen bei wiederholter Verabreichung an Mäuse, wenn PEGylierte Liposomen mit einer kürzeren Alkylkette (C14) PEG-Lipid im Vergleich zu einer längeren Alkylkette C16 PEG-Lipid verwendet wurden.”
Vlatkovic I. Non-Immunotherapy Application of LNP-mRNA: Maximizing Efficacy and Safety. Biomedicines. 2021 May 10;9(5):530. doi: 10.3390/biomedicines9050530. PMID: 34068715; PMCID: PMC8151051. https://pubmed.ncbi.nlm.nih.gov/34068715/
Die Entscheidung hinsichtlich der zu überprüfenden Parameter erfolgt parallel zur und inhaltlich gestützt auf die Nutzen-Risiko-Bewertung des jeweiligen Impfstoffkandidaten im Rahmen des Zulassungsverfahrens.
Und da hat man beschlossen, diverse wichtige Parameter wie DNA-Kontamination, Zeta-Potential und PEG-Kettenlänge des ALC-0159 eben einfach nicht zu messen, bzw. im Falle der DNA einfach mit dem falschen Farbstoff zu messen?
Sie obliegt dem OCABR-Netzwerk (Official Control Authority Batch Release) und basiert auf einem wissenschaftlichen Konsens der amtlichen Expertinnen und Experten, die im Rahmen eines offiziellen Verfahrens die im Labor zu überprüfenden produktspezifischen kritischen Testverfahren, Testparameter und die diesbezüglichen Freigabekriterien identifizieren und festlegen, die relevant für die Wirksamkeit und Sicherheit eines zugelassenen Impfstoffprodukts sind.
Was an dieser Stelle auffällig ist, ist die nahezu identisch ausweichende Antwort der verschiedenen Behörden auf dieses Thema. Hier zum Vergleich eine UK Antwort:
“All batches of licenced Covid vaccines that have been used in the UK vaccination programme have been independently tested under Statutory Rules for testing.
The testing carried out for different vaccines is based on the EU Guidelines for Official Control Authority Batch Release (OCABR) for Human Biologicals: Vaccines, blood and plasma derivatives which can be found on the European Directorate for the Quality of Medicines and Healthcare (EDQM) website. [2]Human OCABR Guidelines - European Directorate for the Quality of Medicines & HealthCare (edqm.eu). Within this link the requirements for testing of influenza vaccines is outlined.
Covid vaccines are tested according to the [3]OCABR activities related to COVID-19 vaccines - European Directorate for the Quality of Medicines & HealthCare (edqm.eu).” (Vaccine Contents - a Freedom of Information request to Medicines and Healthcare Products Regulatory Agency - WhatDoTheyKnow)
Windelweiche Antwort, die nichts aussagt. Das macht fast den Eindruck, als wenn es eine zentrale Datenbank mit vorgegebenen Antworten auf diese Fragen gibt. Das ist mir schon bei SWISSMEDIC aufgefallen. Riecht nach LOCKSTEP, wieder einmal. Immerhin gibt MHRA, anders als das PEI, Links zu den entsprechenden Dokumenten.
Mir wären Experimente, die eine Entscheidung stützen lieber. Belege und Messwerte wären mir übrigens auch lieber als ein „Konsens“. Konsensiert wird bei DieBasis oder im Dackelzuchtverein, das hat nichts mit Wissenschaft zu tun.
Schaut man in die zu testenden Parameter, die oben gelistet werden, hätte man da so einiges testen müssen. Unter anderem:
Reste der DNA-Vorlage
Reste von dsRNA (falls zutreffend)
DsRNA (doppelsträngige RNA) würde über RNA Interferenz Mechanismen (https://de.wikipedia.org/wiki/RNA-Interferenz) noch ein ganz anderes Fass an Problemen aufmachen, die man bei der Wikipedia nachlesen kann, so bekannt ist er Mechanismus. Hat das PEI eigentlich auf dsRNA getestet oder irgendwer da draußen?
DNA-Kontamination war also wohl tatsächlich konsensiert, liebes PEI. Zitiert ihr an dieser Stelle womöglich deswegen nicht die Vorgaben, um die es hier geht?
(https://www.edqm.eu/en/omcl/ocabr-activities-related-to-covid-19-vaccines).
Die Entscheidung ist evidenzbasiert und wissenschaftlich begründet, da sie auf Daten und Erkenntnissen basiert, die im Rahmen des Entwicklungsprozesses erhoben und im Zulassungsprozess geprüft wurden.
An dieser Stellte hätte ich eine Quelle zu den Begründungen und Daten erwartet. Ohne diese Endnote ist das eine reine Behauptung, die leider nicht überprüft werden kann. Bitte senden Sie mir die Belege zu, ich werde sie gerne, kostenfrei, aus rein wissenschaftlichem Interesse, prüfen lassen. Danke im Voraus für ihre Mitarbeit. Oder ist die oben bereits zitierte Liste gemeint, von all den Dingen, die dann nicht gemacht wurden, obwohl sie konsensiert waren?
Neben der experimentellen Prüfung der festgelegten Wirksamkeits- und Sicherheitsparameter durch die amtlichen Prüflabore (OMCL) gehört die Prüfung der Herstellungsdokumentation (Lot Release Protocol, LRP) zum Prüfungsumfang der amtlichen Chargenfreigabe.
Wo finde ich die und wo genau kann ich die herunterladen, die hätte ich gerne, um mir ein eigenes Bild zu machen. Die Maschinenlogbücher der Hersteller bitte auch gleich dazu tun. Bitte senden Sie mir diese Belege zu. Danke im Voraus für ihre Mitarbeit.
Das OMCL prüft die Ergebnisse der vom Hersteller durchgeführten experimentellen Chargenuntersuchungen im Hinblick darauf, ob alle in der Zulassung festgelegten kritischen Parameter und deren Grenzwerte (Spezifikationen) eingehalten wurden.
„vom Hersteller durchgeführten experimentellen Chargenuntersuchungen“
DAS liest sich aber bei den staatlichen Aufgaben des PEI irgendwie anders:
§32 AMG liest sich irgendwie ziemlich eindeutig als: DAS PEI MUSS SELBST PRÜFEN und darf nicht einfach nur abnicken, was der Produzent behauptet:
https://www.gesetze-im-internet.de/amg_1976/__32.html
Ich bin aber kein Jurist, vielleicht verstehe ich da einfach was falsch.
Hier lässt man einen Hersteller, mit einer langen Liste an Verfehlungen (Pfizer), sich selbst eine Bescheinigung ausstellen, dass er diesmal kein Verbrechen begangen hat
DAS versuche ich das nächste Mal beim TÜV. Die sollen mir die Plakette einfach per Post zuwenden, weil ich ihnen am Telefon versichert habe, das Auto ist vollkommen funktionstüchtig und auch verkehrssicher. Ich schwör! Ehrenwort!
Die von den Herstellern verwendeten analytischen Methoden zur Bestimmung von DNA-Restmengen in COVID-19-mRNA-Wirkstoffen ist in den Zulassungsdossiers der zugelassenen mRNA-Impfstoffprodukte beschrieben.
Das Hütchenspiel und die „Tricksereien“, welche der Hersteller gespielt hat, habe ich im Text bereits ausführlichst beschrieben und erläutert.
Im Übrigen fehlt hier der Link zu den referenzierten Dokumenten. Welches EMA Dokument ist hier exakt gemeint? Ohne einen Link oder eine explizite Referenz fällt diese Aussage für mich leider unter „reine Behauptung“. Referenzieren ist wirklich nicht schwierig, einfach einen Link in den Text setzen, so wie ich das mache oder mit Endnoten arbeiten.
Deren Validität wurde entsprechend ICHVorgaben (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use) überprüft und anhand von vorgelegten Daten nachgewiesen.
Dann darf Frau Prof. Dr, König also Fluorimetrische Nachweise machen, weil Sciensano das auch macht und es somit die validierte Methode ist? Warum werden dann die Ergebnisse, die mit eben dieser validierten Methode erhoben wurden, vom PEI angezweifelt?
Jede Wirkstoffcharge des Impfstoffprodukts Comirnaty wird auf DNA-Restmengen untersucht und die Ergebnisse sind Teil des Chargenfreigabeprotokolls des Herstellers, das im Rahmen der amtlichen Chargenprüfung (OCABR) unabhängig behördlich geprüft wird.
Wie der Hersteller dabei getrickst hat, habe ich oben ausführlich erklärt. Cherry picking bei den Methoden. Wenn das so sauber gelaufen ist, dann können diese Chargenfreigabeprotokolle doch auch vom PEI UNGESCHWÄRZT online gestellt werden, dann ist doch von Seiten des PEI nichts zu verbergen oder zu befürchten? Bitte senden Sie mir die Belege zu. Danke im Voraus für ihre Mitarbeit.
Für die staatliche Chargenfreigabe in Deutschland werden diese vom Hersteller mit festgelegter und validierter Methode erhobenen Untersuchungsdaten vom Paul-Ehrlich-Institut gegengeprüft, bevor eine staatliche Chargenfreigabe für Deutschland durch das Paul-Ehrlich-Institut erfolgt.
Dann müsste das PEI auch wissen, dass Fluorimetrie die validierte Methode ist. Wo ist dann das Problem, außer, dass Sciensano/Pfizer den falschen Farbstoff verwendet haben und das dem PEI nicht aufgefallen ist?
Die Testung der Plasmid-DNA-Restmengen erfolgt bewusst am Wirkstoff der COVID-19-mRNA-Impfstoffe (Drug Substance) und nicht am finalen Produkt (Drug Product). Nur so sind mögliche Testinterferenzen durch Lipid-Nanopartikel (LNPs), die erst im finalen Produkt vorliegen, auszuschließen.
Man gibt also zu, dass das finale Produkt aufgrund von LNP Interferenzen bei einigen Parametern gar nicht testbar ist (wie Endotoxine z. Bsp. und LAL, was trotzdem gemacht wird (https://doi.org/10.1002/wnan.1738)).
Das ist irgendwie inkonsequent.
Das Hütchenspiel zur Optimierung des Ergebnisses habe ich schon beschrieben. Warum wurden nicht sowohl DNA als auch RNA mit qPCR bestimmt?
In den Produktionsschritten zwischen der Wirkstoffherstellung und der Herstellung des finalen Produkts kann keine DNA mehr in den Prozess bzw. das Produkt gelangen, sodass bei der Herstellung der finalen Impfstoffdosen aus dem Wirkstoff keine Erhöhung des DNA-Gehalts pro Impfstoffdosis möglich ist.
Interessant. Wenn ein Vial abgelaufen ist aber schon? Die wundersame Vermehrung? Das müsste dann doch auch nicht möglich sein. Die DNA-Menge müsste also nach dieser Argumentation nur abnehmen können, oder?
Die Rest-DNA am Wirkstoff zu testen ist also sensitiver und repräsentativ hinsichtlich des DNA-Gehalts des finalen Impfstoffprodukts.
Korrekt, wenn man die richtigen Methoden nutzt, die das Ergebnis korrekt darstellen würden, wie rtPCR sowohl für DNA als auch RNA. Man kann keinen Quotienten aus zwei unterschiedlichen Methoden bilden, das ist unwissenschaftlich. Entweder reiner UV-spektrometrischer Quotient oder rtPCR-Quotient, aber nicht UV-Spektrometrie mit qPCR mischen. Das hat Pfizer aber getan! Warum hat man den Wirkstoff eigentlich nicht auch mit Fluorimetrie gemessen, wenn man das im Endprodukt macht? Hätte doch auch funktionieren müssen? Wäre dann vielleicht die Konzentration an modRNA zu gering ausgefallen?
Ich weiß nicht, ob das PEI die EMA und TGA Daten kennt. Vielleicht fehlen ihnen diese Daten, die seit Monaten in den zitierten sozialen Medien kursieren tatsächlich, was ich bezweifle, denn schließlich scheint man ja auch Kevins Daten zu kennen. Betreibt das PEI hier cherry picking mit den Daten, so wie man das von Pfizer kennt? Betreibt man falsche Tatsachenbehauptungen durch das Unterlassen von Kontext oder von Daten? Auch eine beliebte Methode der Manipulation.
FAZIT
1. Das PEI stellt bezüglich DNase-Verdau Behauptungen auf, die von der EMA bereits seit über einem Jahr widerlegt sind.
2. Das PEI zweifelt Untersuchungsmethoden der modRNA-Produkte an, die von den OMCL Laboren so auch verwendet werden, aber wahrscheinlich mit dem falschen Farbstoff.
3. Das PEI zieht OCABR Regel als Beleg heran, dass etwas nicht getan werden muss, was in den OCABR Regeln aber als zu untersuchen festgelegt ist.
4. Das PEI ignoriert seinen gesetzlichen Auftrag nach AMG, den es in einer eigenen Publikation als Qualitätsmerkmal hervorhebt.
5. Das PEI veröffentlicht eine Publikation über Untersuchungen, die es angeblich im Schichtdienst als OMCL gemacht hat, während es dem MDR schreibt, keine Untersuchungen durchzuführen und auch vor Gericht ausgesagt hat, dass nur Sichtkontrollen durchgeführt werden.
Si tacuisses, philosophus mansisses!
Oder wie Dieter Nuhr so schön sagt:
„Wenn man keine Ahnung hat, einfach mal die Klappe halten.“
Und dann gibt auch noch das Sprichwort:
“Schlafende Hunde sollte man lieber nicht wecken.”
Liebe Leser,
ich selbst habe praktisch keine Reichweite, die Daten unter die Leute zu bringen. Solltest Du Reporter sein, bediene dich einfach. Ich schenke dir meine Recherche. Du brauchst mit nicht einmal referenzieren. Mir reicht es, wenn die Daten nach nochmaliger Prüfung durch Dich weite Verbreitung finden. Wenn Du mich referenzieren willst, ist das OK, ich bestehe aber nicht darauf. Ich genieße es durchaus, zu beobachte, wie meine Daten langsam, über diverse Quellen, Panik bei den Verursachern verursachen, wie das Cichutek 1994 Paper.
Wie man sich aus seinen eigenen Worten einen Strick dreht weiß der Klausi
Mein Freund sagt immer: „Wenn es so weit ist, will ich einfach nur am Straßenrand sitzen, Hanfseile flechten und den frisch aufgewachten Geschlumpften zuarbeiten.“ So wie ich das im Falle von Klausi Cichutek sehe, hat der sich sein Seil mit Worten bereits vor 29 Jahren selbst geknüpft.
Alle meine Quellen sind öffentlich zugänglich. Sieh den Artikel einfach als verspätetes Weihnachtsgeschenk an die Menschheit.
Mein Dank gilt an diejenigen, die mir bei diesem Artikel im Hintergrund Tipps und Infos gegeben haben, so dass er von einem ersten Entwurf von 18 Seiten Fingerübung von 4h Spaß an Weihnachten zu 29 Seiten und viele Stunden Arbeit und Korrekturen an den beiden Weihnachtstagen anwuchs.
Danke an Doctora, Wilfried, Werner, a_concerned_amyloidosis, der_Kanalräumer und allen, die ihre Fundstücke zumindest auf Twitter posten, damit ich sie bündlen und in einen Kontext setzen kann.
Ich sammel nur Daten und setze Puzzlestücke zusammen, die einsam und allein im Internet herumliegen und nach einem Kontext suchen.
Die Realsatire schreibt sich anschließend praktisch von alleine. Die Behörden liefern dabei die Schreibprompts und das Gerüst, an dem ich mich entlang hangeln kann. Daher danke auch an das PEI für seine lustigen Schreibprompts.
Updates:
Der Artikel ist work in progress. Wenn ich mich an Infos erinnere oder auf neue Infos stoße oder Fehler gemacht habe, korrigiere ich das und lieste hier die Änderungen.
6.1.2024: Grenzwerte klassische Impfstoffe + nicht gemachte Massenspektrometrie der PEG-Kettenlänge, EMA SV40 Mail, Fluoreszensfarbstofflinks.
8.1.2024: Erratum, ich dachte RNA wird bei 280 nm gemessen und man könnte einen Quotienten bilden (habe nie mit RNA gearbeitet, nur mit Proteinen und die werden bei 280 nm gemessen. Vielleicht war auch ein wenig Wunschdenken dabei). Ich habe das korrigiert. Ein Quotient ist bei UV-Spektrometrie gar nicht möglich, da beide Substanzen DNA und RNA bei 260 nm absorbieren. Damit ist die Messmethode generell komplett ungeeignet, diese Substanzen zu messen, wenn sie sie gar nicht unterscheiden kann. Da könnte nur DNA drinnen sein und man würde das nicht merken.
9.1.2023: Antwort Swissmedic zu nicht vorhandenen DNA Grenzwerten, Dhuli K Paper als Insertionsbeweis, Extinktionskoeffizient modRNA (biorxiv.org/content/10.1101/2023.07.27.550903v2.full.pdf ) hinzugefügt.
10.01.2024: Brogna Paper + Igors Substack dazu.
20.01.2024: Bancel Twitter Poster/Patent


















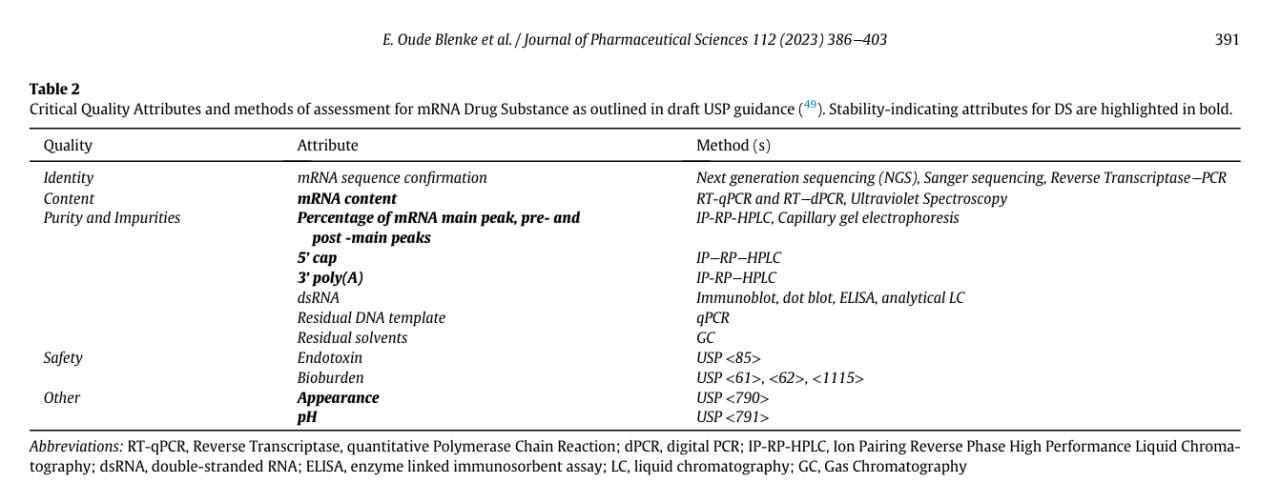
















































Zur Sache, wonach die WHO-Guideline „Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks” (https://cdn.who.int/media/docs/default-source/biologicals/documents/trs_978_annex_3.pdf) keine Gültigkeit hat.
Das eigentlich relevante Dokument (https://iris.who.int/bitstream/handle/10665/42013/WHO_TRS_878.pdf) legt im Annex 1 erstmals den Grenzwert von 10 ng/Dosis fest. In der Tat bezieht sich die WHO dabei ausdrücklich auf "continuous cell lines" tierischen Ursprungs (die Formulierung des PEI ist dahingehend missverständlich, es handelt sich im Grunde um standardmäßig verwendete Tumorzellinien). Ebenfalls werden einige Zelltypen, darunter Bakterien, ausdrücklich ausgeschlossen.
Was dabei interessant ist: Es gibt (zmd meines Wissens nach) sonst keine Quellen, die auch nur ansatzweise mit DNA-Grenzwerten in Impfstoffen zu tun haben. Wenn das PEI also nun korrekt festhält, dass die o. g. Richtlinie keine Anwendung bei bakteriell/biochemisch erzeugten Produkten findet, dann ist der von der EMA angewandte Grenzwert nicht nur unangemessen, sondern endgültig frei erfunden.
Interesting aspect here in addition:
https://norberthaering.de/new/ocabr-protocol/