Sichtbare Partikel in parenteralen Arzneimitteln - Es gibt keine Grenzwerte
Das Problem betrifft alle Injektionsflüssigkeiten
Die COVID modRNA-Produkte wurden von diversen Menschen im Lichtmikropskop untersucht und viele fanden sichtbare Partikel.
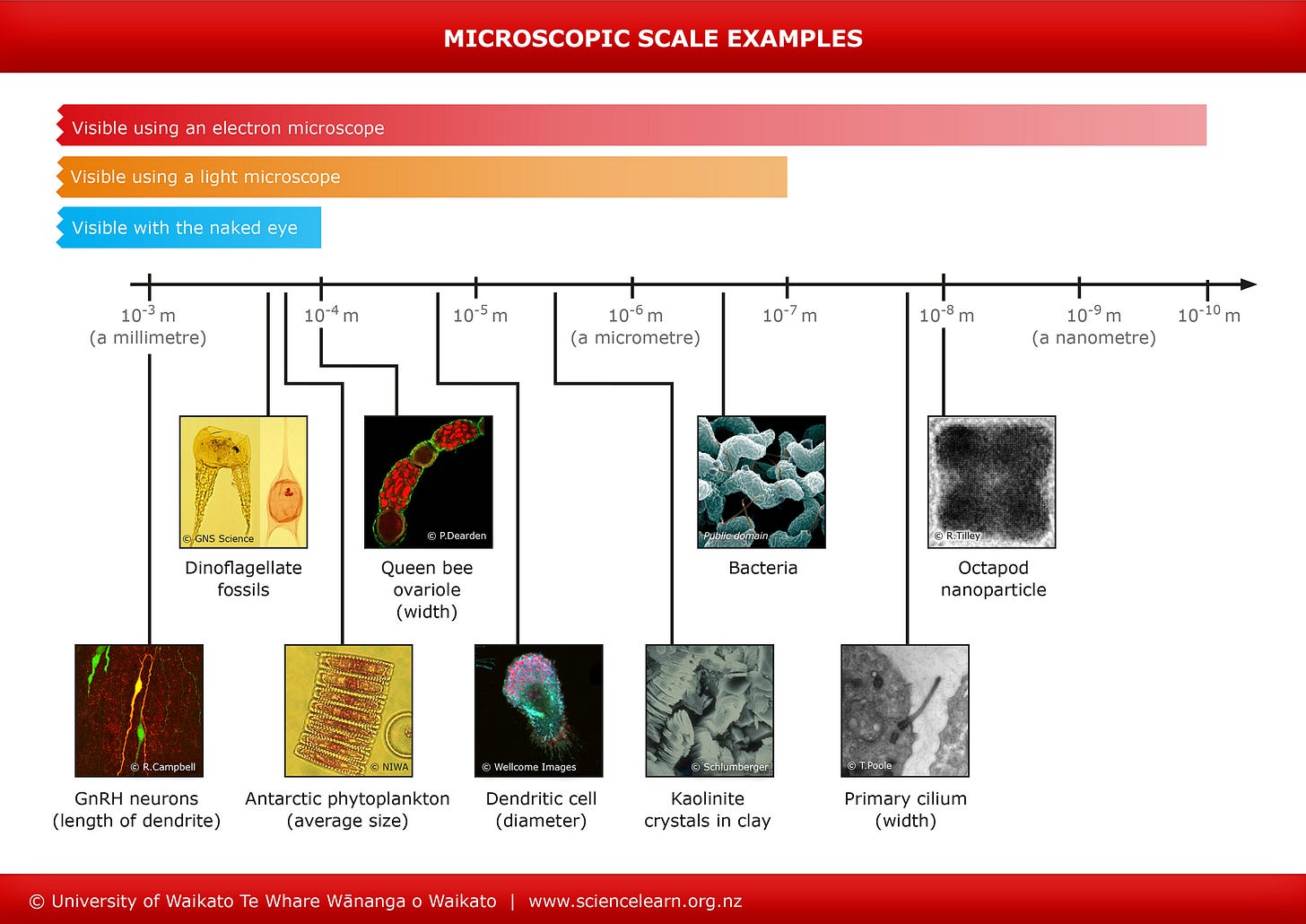
Um die Größe dieser Partikel abschätzen zu können, muss man zurück in den Stoff der neuten Klasse: Auflösungsvermögen verschiedener Mikroskoptypen.
Bakterien kann man zwar im Lichtmikroskop sehen aber nicht alle. Spirillen sieht man noch recht gut, weil lang. Bei Kokken wird es schon schwierig, da braucht man Ölimmersionsmikroskopie mit speziellem Objektiv. Andererseits gibt es auch Bakterien, die man mit bloßem Auge sieht.2
Generell kann man sagen, ist eine Flüssigkeit durch einen Sterilfilter gegangen (0,33µm oder 0,23µm) sieht man nichts mehr im Lichtmikroskop, weil Bakterien herausgefiltert sein sollten (Sporen können durchgehen).
Sieht man also etwas im Lichtmikroskop, kann es eigentlich nicht durch einen Sterilfilter gegangen sein.
Gesehen hat man aber recht große Cholesterolkristalle.3 Gehen wir einfach mal davon aus, dass das Produkt partikelfrei die Fabrik verlassen hat, aber wenn es zerfallen ist (schlechte Lagerung, falsche Handhabung, Produktionsfehler) das Cholesterol der LNPs als scharfkantige Kristalle auskristallisierte.
Cholesterolkristalle sind groß und scharfkantig. Nichts, was man in Kapillaren gelangen lassen sollte.
Nun stellt sich die Frage: Warum wurde da nicht eingegriffen, da muss es Regelungen, Vorschriften und/oder Gesetze geben.
Ein Paper hat Maria Gutschi gefunden:
Liu F, Hutchinson R. Visible particles in parenteral drug products: A review of current safety assessment practice. Curr Res Toxicol. 2024 Jun 9;7:100175. doi: 10.1016/j.crtox.2024.100175. PMID: 38975062; PMCID: PMC11223083. https://pubmed.ncbi.nlm.nih.gov/38975062/
Diese Paper will ich hier auf deutsch übersetzen, kürzend auf die Highlights zusammenfassen und teilweise kommentieren. Zitate sind zur besseren Lesbarkeit entfernt, können aber im original Paper nachgeschaut werden, das frei verfügbar ist.
Zitate sind kursiv geschrieben.
Abstract
Das Vorhandensein von Partikeln in parenteralen Arzneimitteln (PDPs) stellt ein potenzielles Sicherheitsrisiko für Patienten dar. Es gibt unterschiedliche Leitlinien und Praktiken für sichtbare (VPs) und subvisuelle Partikel (SVPs) in parenteralen Arzneimitteln. Für SVPs wurden die Mengenbeschränkungen in mehreren Pharmakopöen harmonisiert. Die pharmazeutische Industrie hält sich an die empfohlenen Grenzwerte für die Einhaltung von Vorschriften und Qualitätsstandards. Für VPs wurde jedoch kein solcher akzeptabler Grenzwert festgelegt. Dies führt nicht nur zu Qualitätsproblemen, sondern auch zu Sicherheitsherausforderungen für Hersteller und Arzneimittelentwickler bei der Verwaltung und Bewertung von VPs.
Für sichtbare Partikel in Injektionsflüssigkeiten gibt es also keine Grenzwerte. Daher wurde diesbezüglich nichts unternommen und es dürfte auch schwierig werden dagegen vorzugehen, wenn es keine Grenzwerte und Regeln gibt.
Introduction
Selbst mit den heutigen gut kontrollierten Herstellungsprozessen und regulierten und gut praktizierten Partikeldetektionstechnologien durch 100-%-Prüfprogramme kann beim aktuellen Stand der Technik in der Fertigung keine absolute Sicherheit für die Abwesenheit von Partikeln garantiert werden. Das Auftreten von Partikeln in parenteralen Arzneimitteln kann auf den Herstellungsprozess und die Herstellungsumgebung (Design, Qualifizierung, Validierung, Ausführung) sowie auf die Handhabung nach der Produktion, die Lagerbedingungen, den Transport und die Handhabung durch Endverbraucher zurückzuführen sein. Auch die Art der Formulierungen (z. B. therapeutische Proteine) kann zum Auftreten von Partikeln beitragen.
Das ist dann auch das Problem der modRNA-Produkte. Falsche Handhabung und schon kristallisiert da etwas aus. Kein Wunder bei einer Mischung aus Sucrose, Tris-Puffer (2021 noch Phosphatpuffer), Cholesterin. Das muss keine Reinkristalle (fraktionierte Kristallisation) sein, das kann auch zu Mischkristallen führen.4
Partikel stellen eine Kontamination dar, da sie nicht beabsichtigt und technisch unvermeidbar sind, unabhängig von den Darreichungsformen der medizinischen Produkte (DPs). Die Partikelkontamination von Arzneimitteln gilt als Indikator für die allgemeine Produktqualität und kann sich auf die Patientensicherheit und die Wirksamkeit des Produkts auswirken. Aufgrund von Qualitäts- und Sicherheitsbedenken in Bezug auf Partikel in parenteralen Arzneimitteln kam es bereits zu Produktrückrufen und daraus resultierenden Engpässen. Laut Daten der US-amerikanischen FDA führten partikelbedingte Probleme im Zeitraum von 2008 bis 2012 zu 22 % der Produktrückrufe für parenterale Arzneimittel. Im Jahr 2014 wurden laut US-FDA 16 injizierbare Depotpräparate aufgrund von Partikelkontamination zurückgerufen. Das Auftreten von Partikeln ist auch einer der häufigsten Qualitätsgründe für einen Mangel an Depotpräparaten. Aufgrund der erheblichen Auswirkungen hat die US-amerikanische FDA die Verteilung von Medikamenten, die bei der Inspektion Partikel enthalten, unter der Bedingung genehmigt, dass vor der Verabreichung ein Filter verwendet wird, um das Partikelrisiko für den Patienten auszuschließen.
Das Paper schreibt das, was ich denjenigen auch immer schreibe, die mich wegen Partikeln in Betäubungen beim Zahnarzt anschreiben. Die Partikel gab es schon immer, hat nur keinen gestört. Man hat nicht hingeschaut. Injektionsflüssigkeiten waren schon immer schmutzig aber steril. Beim TÜV für Biotechnologiesicherheit, wo ich als Student die Spül- und Medienküche gemacht habe, sagte immer: “Auch Dreck kann steril sein”. Jetzt, nachdem wir in den letzten Jahren gelernt haben, wie die Pharma tatsächlich arbeitet, fällt es einem in diversen anderen Bereichen auf, dass es da schon immer Probleme gab.
Der Tipp der FDA ist eigentlich ganz gut: Sterilfilter vorschalten ABER der bindet auch einen Teil der Substanzen, das kann auch suboptimal sein, bis der Filter abgesättigt ist. Für kleine und Kleinstmengen ist Vorfilter wahrscheinlich ungeeignet, weil zu viel therapeutische Substanz im Filter adsorbieren könnte.
Sicherheit von sichtbaren Partikeln (VP)
Es gibt keine veröffentlichten behördlichen Leitlinien zu den potenziellen Auswirkungen einer geringen Anzahl von VPs auf die Patientensicherheit. Daher ist die Sicherheitsbewertung von VPs in DPs eine Praxis der Selbstregulierung und -bewertung in der pharmazeutischen Industrie. Zwar gibt es veröffentlichte Literatur zu anekdotischen Berichten, die die Exposition gegenüber einer großen Anzahl von Partikeln und die daraus resultierenden nachteiligen Auswirkungen beschreiben, doch handelt es sich bei dieser Literatur um eine Extremsituation, die nicht die potenziellen Gefahren einer eher typischen Partikelexposition durch häufig verabreichte parenterale Arzneimittel widerspiegelt.
Im Klartext: Das erklärt, warum keine Staatsanwaltschaft reagiert hat, wenn man ihnen die Partikel unter dem Lichtmikroskop gezeigt hat. Die Pharmazeutische Industrie arbeitet nach hausinternen Regeln und reguliert sich selbst. Also wahrscheinlich eher gar nicht, wie man an den Zwischenfällen mit Metallpartikeln bei Moderna sieht, die dennoch ausgeliefert wurden.5 6
Es liegen nur begrenzte Daten über die Exposition des Menschen gegenüber infundierten Partikeln in typischen medizinischen Umgebungen und die damit verbundenen gesundheitlichen Auswirkungen vor. Dies macht die Bewertung der Partikelsicherheit angesichts der Beschaffenheit der Partikel im Vergleich zu anderen Arten von Arzneimittelverunreinigungen (z. B. extrahierbare und auslaugbare Substanzen, Lösungsmittelrückstände, elementare Verunreinigungen) zu einer Herausforderung.
[…]
Die Sicherheit von Partikeln wird durch ihre Eigenschaften wie Größe, Volumen (oder Dosis), Oberflächenladung und Morphologie beeinflusst. Daten aus Studien zur Exposition von Menschen und Tieren haben gezeigt, dass die Partikelgröße ein kritischer Parameter für das potenzielle Sicherheitsrisiko nach einer Partikelexposition ist. Sie hat Auswirkungen auf die Positionierung und Verteilung der Partikel im menschlichen Körper.
Das ist nicht neu, dazu habe ich einiges beim Thema Thrombosen geschrieben.7
Bei intravenöser Exposition
lagern sich Partikel mit einer Größe von ≤1 µm überwiegend in der Leber ab,
während sich Partikel mit einer Größe von 3–6 µm in der Milz und den hepatischen Lymphknoten ablagern.
Partikel mit einer Größe von ≥10 µm passieren das Lungengefäßbett langsam und werden voraussichtlich in der Lunge zurückgehalten, es sei denn, sie können über den kollateralen Blutkreislauf durch die Lunge zu anderen Organen gelangen.
Bei einer Partikelgröße von ≥50 µm wird davon ausgegangen, dass sie in der Lunge eingeschlossen werden.
Die größenabhängige Biodistribution steht in Zusammenhang mit der Blutflussrichtung und der Größe der Blutgefäße.
[…]
Die Größe der arteriellen Gefäße in der Lunge nimmt in Richtung des Blutflusses ab und endet in Lungenkapillaren, die typischerweise einen Durchmesser im Größenbereich von 6 bis 8 µm haben. Dies entspricht der Größe eines menschlichen Erythrozyten. Infolgedessen werden die meisten Partikel, die größer als diese Größe sind, in kleinen Lungenarteriolen oder in den Lungenkapillaren eingeschlossen, während kleinere Partikel hindurchtreten können. In manchen Fällen kann ein größeres Partikel über den kollateralen Blutkreislauf durch die Lunge gelangen. Kleinere Partikel, die die Lungenkapillaren passieren, können über die Lungenvene zur linken Herzseite und dann über den systemischen Kreislauf transportiert werden und sich in den Kapillaren anderer Organe (z. B. Leber und Milz) ablagern, wo sie von Zellen des retikuloendothelialen Systems phagozytiert werden können.
[…]
In der Literatur wurde über größenbedingte Auswirkungen berichtet. Die Einführung von Mikrosphären mit einer Größe von 40–120 µm wurde mit Fällen von tödlichen pulmonalen Komplikationen nach einer therapeutischen intraarteriellen Embolisation in Verbindung gebracht; als die Größe der Mikrosphären jedoch auf 100–300 µm erhöht wurde, wurde über einen Studienzeitraum von 8 Jahren kein Todesfall gemeldet.
[…]
Die Partikelform, Oberflächeneigenschaften (Ladung und Fläche) und Härte spielen ebenfalls eine wichtige Rolle für die Partikelsicherheit.
[…]
Es wird erwartet, dass eine lange und dünne Faser eher ein kleines Gefäß verschließt als ein kugelförmiges Partikel. Die Oberflächeneigenschaften von Partikeln können auch ihr Schicksal und ihre Wirkung im menschlichen Körper beeinflussen. Die Blut-Clearance und Organverteilung kleiner Partikel (1,305 µm) wurde durch ihre Oberflächenladung beeinflusst, wie eine Tierstudie mit Ratten zeigte.
[…]
Negativ geladene Partikel blieben in der Leber hängen, während positiv geladene Partikel sich zunächst in der Lunge ansammelten und später in der Milz hängen blieben.
[…]
Der Gefäßverschluss durch ein weiches Partikel kann aufgrund seiner Formbarkeit überwunden werden, die ein hartes Partikel nicht besitzt. Infolgedessen können weiche Partikel physiologische Auswirkungen auf nachgeschaltete lebenswichtige Organe haben.
[…]
Die pädiatrische Bevölkerung hat ein höheres Risiko im Zusammenhang mit Partikeln als die erwachsene Bevölkerung, was durch unterschiedliche kardiovaskuläre Merkmale und die therapeutische Verabreichung erklärt werden kann. Insbesondere Neugeborene oder unreife Frühgeborene scheinen gefährdet zu sein.
[…]
Es wurde berichtet, dass bereits bestehende Erkrankungen die Auswirkungen von Partikeln verschlimmern können.
Wen hat man geimpft? Kinder? Säuglinge? Menschen mit bestehenden Erkrankungen?
Bei schwerkranken Kindern wurde festgestellt, dass die Infusionen von Partikeln eine Veränderung der Mikrozirkulation verursachen können, was zu systemischen Entzündungsreaktionen mit negativen Auswirkungen auf die Organe führt.
[…]
Die durch Proteinaggregate ausgelöste Immunantwort wird durch verschiedene Faktoren beeinflusst. Proteinaggregate mit hochmolekularen Antigen-Arrays können unabhängig von T-Helferzellen effizient eine Antikörperreaktion auslösen, während weniger geordnete Proteinaggregate T-Helferzellen erfordern. Die Multimerisierung ist eine Voraussetzung dafür, dass Proteinaggregate Immunantworten auslösen können. Größere Multimere mit einem Molekulargewicht von >100 kD und >20 Liganden pro Aggregat sind bei der Auslösung von Immunreaktionen effizienter als Aggregate mit niedrigem Molekulargewicht. Zu den weiteren Faktoren gehören das Vorhandensein von Neoepitopen, Unterschiede in der Glykosylierung und das Vorhandensein von Kontaminanten mit immunmodulatorischer Aktivität.
Hier erinnere ich ungern daran, dass das Spike Protein Multimere zu bilden scheint.
Diese Proteinaggregate bilden sich im Falle der C-Spritzen nicht im Produkt selbst sondern erst später, aber es ist interessant, dass größere Aggregate immunogener sind als kleinere Proteinaggregate.
Die Kenntnis der Eigenschaften von Proteinaggregaten ist wichtig, um ihr Potenzial für Immunogenität zu bewerten.
Das hat leider niemand gemacht. Die JN.1 Spitze unterscheidet sich laut bei in 30 Aminosäuren von XBB9. Das ist ein sehr, sehr anderes Protein, als das, welches in den Studien gebildet wurde. Dieses Protein ist nicht charakterisiert, wir wissen wenig bis nichts über seine Eigenschaften. In meiner Promotion hatten schon deutlich weniger Aminosäureaustausche extreme Effekte auf Stabilität und Faltung.
Da es keine validierten In-vitro- und Tiermodelle gibt, muss das Immunreaktionspotenzial von Proteinaggregaten in therapeutischen Proteinen letztendlich in klinischen Studien bewertet werden. Darüber hinaus ist es bei klinischen Studien von entscheidender Bedeutung, dass die Eigenschaften von Proteinaggregaten gut charakterisiert und verstanden werden, um akzeptable Profile (d. h. Menge und Eigenschaften) von Proteinaggregaten für die Exposition von Patienten und die Sicherheitsbewertung zu erstellen. Außerdem können Pharmakovigilanzdaten Aufschluss über einen möglichen Zusammenhang zwischen Proteinaggregaten und Immunogenität geben.
Das Problem in diesem Fall ist, die Endproduktion ist im Patienten. Das Proteinaggregat wurde vorher nie getestet und kann von Mensch zu Mensch variieren.
Schlussfolgerung
Es gibt keine Regel und Grenzwerte, mal wieder. Das kennen wir bereits.10
Es gibt keine validen Studien zu möglichen Schäden.
Die Pharma kontrolliert sich freiwillig selbst nach unbekannten Regeln. Also möglicherweise gar nicht.
Das Problem ist uralt, bekannt und wird daher (möglicherweise aufgrund von Lobbymaßnahmen) ignoriert und nicht reguliert. Das Problem betrifft alle flüssigen Medikamente.
Über Partikel in den Produkten sind die Hersteller juristisch nicht zu bekommen, weil es keine Grenzwerte und keine Regeln gibt. Das betrifft alle flüssigen Medikamente, wie Betäubungsmittel oder andere Injektionsflüssigkeiten.
Die EU hat seit 2020 Regeln, die sind aber non-mandatory also unverbindlich.
Das neue, nicht obligatorische allgemeine Kapitel 5.17.2. Empfehlungen zu Tests auf Partikelkontamination: sichtbare Partikel enthält Informationen zur Sichtprüfung und Kontrolle sichtbarer Partikel in flüssigen Zubereitungen, für die Tests gemäß dem allgemeinen Kapitel 2.9.20. Partikelkontamination: sichtbare Partikel gelten.
Nicht verbindliche Regeln sind nett, das war’s dann auch. Damit kommt man nicht weiter, da ist man auch wieder nur bei freiwilliger Selbstverpflichtung.
Laut GMP müssen sie frei von sichtbaren Partikeln sein.11 GMP verweist dann aber wieder auf die Arzeneimittelbücher und da ist es schon wieder nicht verpflichtend.
The microscopic scale. (n.d.). Science Learning Hub. https://www.sciencelearn.org.nz/resources/497-the-microscopic-scale
Podbregar, N. (2022, June 27). Größtes Bakterium der Welt entdeckt. Scinexx | Das Wissensmagazin. https://www.scinexx.de/news/biowissen/groesstes-bakterium-der-welt-entdeckt/
Die Interpretation des Papers ist Quatsch, die Aufnahmen und Beobachtungen aber gut. Real-Time Self-Assembly of Stereomicroscopically Visible Artificial Constructions in Incubated Specimens of mRNA Products Mainly from Pfizer and Moderna: A Comprehensive Longitudinal Study. (2024). International Journal of Vaccine Theory, Practice, and Research , 3(2), 1180-1244. https://doi.org/10.56098/586k0043
Some Vaxx analysis raw data
Es gibt deutlich mehr Daten im Hintergrund, als man so glaubt. Unglücklicherweise können einige Wissenschaftler diese nicht publizieren, weil sie noch einen Job haben, den sie lieben und nicht gefeuert werden möchten, bzw. ihre Laborzugangsrechte nicht verlieren möchten, sollten sie emeritiert sein.
Afp. (n.d.). Moderna says COVID vaccines sent to Japan contained stainless steel particles. Japan Today. https://japantoday.com/category/national/moderna-says-tainted-covid-vaccines-sent-to-japan-contained-steel
Moderna vaccine production continues in EU amid contamination probe. (2021, August 27). Reuters. Retrieved November 23, 2024, from https://www.reuters.com/business/healthcare-pharmaceuticals/contaminant-moderna-vaccines-suspected-be-metallic-powder-nhk-2021-08-27/
Vitriol, D. V. (2024d, January 22). X Mechanismen der Thrombosenbildung durch die Plörre. DrBine’s Newsletter. https://drbine.substack.com/p/5-mechanismen-der-thrombosenbildung
X Mechanismen der Thrombosenbildung durch die Plörre
Mögliche Thrombosemechanismen durch die COVID-Injektionen
Bangaru, S., Ozorowski, G., Turner, H. L., Antanasijevic, A., Huang, D., Wang, X., Torres, J. L., Diedrich, J. K., Tian, J., Portnoff, A. D., Patel, N., Massare, M. J., Yates, J. R., Nemazee, D., Paulson, J. C., Glenn, G., Smith, G., & Ward, A. B. (2020). Structural analysis of full-length SARS-CoV-2 spike protein from an advanced vaccine candidate. Science, 370(6520), 1089–1094. https://doi.org/10.1126/science.abe1502
RKI - Impfen - COVID-19-Impfempfehlung (Stand 26.9.2024). (n.d.). https://www.rki.de/SharedDocs/FAQ/COVID-Impfen/FAQ_Liste_STIKO_Empfehlungen.html
Vitriol, D. V. (2024h, February 27). Es gibt für die modRNA-Produkte keinerlei Grenzwerte/Akzeptanzkriterien. DrBine’s Newsletter. https://drbine.substack.com/p/es-gibt-fur-die-modrna-produkte-keinerlei
Es gibt für die modRNA-Produkte keinerlei Grenzwerte/Akzeptanzkriterien
Ich bin in einem Paper von 2023 auf Hinweise gestoßen, dass es gar keine Grenzwerte für die Plörre gibt und nicht mal die WHO es geschafft hat Grenzwerte gegen die Hersteller durchzusetzen. Eigentlich geht es in dem Paper um ganz andere Themen, aber es wird eben auch das Grenzwertproblem bzw. das nicht existieren von Akzeptanzkriterien für die modRNA-Pl…
GmbH, C. H. (2024, October 7). Müssen Parenteralia 100% frei von Partikeln sein? GMP Navigator. https://www.gmp-navigator.com/gmp-news/muessen-parenteralia-100-frei-von-partikeln-sein





In 2021 hatte Arne Burkhardt mit Crew die Reste der Injektionslösungen mal unter ein vernünftiges Mikroskop gelegt und im Corona-Ausschuss auch Aufnahmen anderer Mikroskop-Inhaber gezeigt.
Das war so spooky, dass ich es sofort mental verwerfen musste. Da waren nicht nur biologische und chemische Ingridienzien zu sehen, sondern auch augenscheinlich mechanische.
Und weil so viel Irres inzwischen wahr geworden ist, vermute ich, dass mit der Plörre "on the fly" alles Mögliche versucht wurde. Das war das größte Feldexperiment ever.
Deswegen ist es auch so schwer, die Spritzenopfer zu vergleichen. Die Suppe wurde immer wieder angepasst und verändert. Zuviel Tote - dann schickten sie halt mal ein paar Chargen raus, die harmlos waren, um die Statistik zu entkräften.
Da spielen Politik, Geheimdienst, Militär und Wissenschaft Gott. Das muss dringend gestoppt werden. Zusammen mit der Gain-of-function-"Forschung".
Using Google translate
Es besteht eine größere Wahrscheinlichkeit, dass durch einen Stoß Edelstahlpartikel in den Körper gelangen als durch den Müll in den Fläschchen.
There is a greater chance of a Jab introducing Stainless Steel particles than the junk in the vials.
https://geoffpain.substack.com/p/nickel-not-nocebo-explains-a-lot