X Mechanismen der Thrombosenbildung durch die Plörre
Auch Thrombosen lieben Diversität
Mögliche Thrombosemechanismen durch die COVID-Injektionen
Es ist mittlerweile hinlänglich bekannt, dass die COVID-Injektionen Thrombosen auslösen. Die Erkenntnis um die Vielfalt der Mechanismen jedoch, durch welche das geschehen kann, wächst von Monat zu Monat.
Grob sind mir aktuell 6 mögliche Mechanismen, durch welche die COVID-Injektionen Thrombosen auslösen können bekannt. Daher steht im Titel nur noch X Mechanismen. Es kommen immer welche dazu. Also habe ich mich für die Variante X = ganze natürliche Zahl entschieden, damit ich den Titel nicht jedes Mal ändern muss.
Einleitung/Vorwissen
Funktion des Gerinnungssystem und Schäden durch das Gerinnungssystem
Dieses Kapitel ist entnommen, übersetzt und gekürzt aus: https://www.futuremedicine.com/doi/full/10.2217/nnm.13.48
Über die einfache Aufrechterhaltung des Flüssigkeitsstatus des Blutes und die Verhinderung von Blutungen hinaus ist die Gerinnung ein wesentlicher Bestandteil des angeborenen Immunsystems. Als Reaktion auf Produkte von Krankheitserregern im Blut kann der Gerinnungsprozess beispielsweise die Ausbreitung von Infektionen verhindern. Pathogene wiederum haben verschiedene Ansätze entwickelt, um diese Hindernisse zu überwinden, indem sie Antikoagulationsmechanismen auslösen, z. B. die fibrinolytische Aktivität. Wenn die ursprünglich schützende Funktion des Gerinnungssystems aus dem Gleichgewicht gerät, kann sie schädlich werden. So führt beispielsweise ein durch eine Infektion ausgelöstes Blutgerinnsel zu Gewebeschäden und multiplem Organversagen; die disseminierte intravasale Gerinnung ist eine häufige Komplikation bei Sepsis und kann auch durch eine übermäßige Exposition gegenüber Endotoxin ausgelöst werden. Eine Fehlfunktion der Gerinnungskaskade ist für Komplikationen und Mortalität bei Herz-Kreislauf-Erkrankungen, Autoimmunreaktionen, allergischen Reaktionen, Verletzungen und Krebs verantwortlich. Es ist bekannt, dass das Fortschreiten von Krebs mit einem erhöhten prokoagulativen Zustand einhergeht, und die Entwicklung einer Thrombose, die bei Krebspatienten häufig auftritt, ist ein Indikator für eine schlechte Krankheitsprognose. Krebszellen selbst sind in der Lage, die Gerinnung durch die Induktion proinflammatorischer Zytokine, die Expression gerinnungsfördernder Moleküle auf ihrer Oberfläche und die Interaktion mit Blutplättchen auszulösen.
Der Mehrkomponentencharakter des Gerinnungssystems wird durch die Virchow'sche Trias veranschaulicht, die die pathologischen Schritte bei der venösen Thrombose erklärt:
1. Hyperkoagulabilität
2. Stase (Veränderungen der Hämodynamik)
3. Endothelschädigung
Wendet man diese Trias auf das Gerinnungssystem an, lassen sich drei Hauptkomponenten unterscheiden:
Zellen (Thrombozyten und Endothelzellen)
Blutplättchen, auch Thrombozyten genannt, sind kleine (~2 µm) scheibenförmige anukleäre Zellen, die im Knochenmark gebildet werden.Thrombozyten enthalten Granula, die mit Wachstumsfaktoren (z. B. PDGF und PF4), kleinen Molekülen(ATP und Serotonin) und Ionen (Ca2+) gefüllt sind.Die Aktivierung der Thrombozyten führt zu einer Degranulation, die zur Aktivierung von Endothelzellen, Leukozyten und anderen Thrombozyten dient und Veränderungen in der Morphologie der Thrombozytenzellen bewirkt, was schließlich zur Bildung eines Thrombus führt (daher die Bezeichnung Thrombozyten"). Sie erfüllen auch phagozytische Funktionen und können auf Krankheitserreger mit der Aktivierung von Signalwegen reagieren, was zur Expression von entzündungsfördernden Proteinen führt.
Eine weitere zelluläre Komponente, die für die Homöostase entscheidend ist, sind die Endothelzellen. Unter normalen physiologischen Bedingungen sorgen ruhende Endothelzellen für eine Umgebung, in der das Blut fließen kann, und bilden eine Barriere, die verhindert, dass Blutzellen mit der extrazellulären Matrix in Kontakt kommen. Wenn ein Blutgefäß beschädigt ist, verhindern die Endothelzellen den Blutverlust, indem sie die Gerinnung einleiten, und sie verhindern die Thrombose, indem sie die Gerinnselbildung im beschädigten Bereich lokalisieren und die Fibrinolyse erleichtern. Endothelzellen haben auch eine Funktion bei Entzündungen und anderen pathophysiologischen Zuständen.
Blutproteine (Gerinnungs-/Gerinnungsfaktoren)
Die zweite Komponente der Virchow-Trias sind die Blutgerinnungsfaktoren (Proteine im Blutplasma). Diese Faktoren lassen sich grob in zwei Gruppen einteilen:
1. Zymogene (Proenzyme, die in aktive Enzyme umgewandelt werden können)
2. Kofaktoren ohne enzymatische Aktivität.
Diese Faktoren bilden zwei Kaskaden, die als intrinsischer und extrinsischer Gerinnungsweg bezeichnet werden. Beide Wege führen zur Bildung von Thrombin. Der extrinsische Weg erleichtert auch die Umwandlung von Fibrinogen in Fibrin und führt schließlich zur Gerinnungsbildung.
Blutfluss:
Die dritte Komponente der Virchowschen Trias ist der Blutfluss. Wichtige Parameter des Blutflusses bei der Gerinnung sind die Scherspannung und die Scherrate. Diese beiden Parameter beeinflussen die Zelladhäsion, die Freisetzung von Thrombozyten und Gerinnungsfaktoren sowie die Bildung von Gerinnseln.
Thrombentypen:
Klassischerweise unterscheidet man die Thrombustypen nach ihrer Zusammensetzung.
Gerinnungsthrombus (roter Thrombus, blutreich)
Abscheidungsthrombus (weißer Thrombus, fibrinreich, schichtweise Fibrin und Thrombozytenaggregate, in denen sich Erythrozyten und Leukozyten verfangen haben)
Plättchenthrombus (vorwiegend aus Thrombozyten bestehend)
Fibrinthrombus (Thrombus, der nur aus Fibrin besteht, klassischerweise außerhalb des Blutgefäßes koagelbildend)
(ISBN-13 : 978-3384019820 S. 83)
Da das Thema der Thrombenbildung nach Covid-Injektion jedoch bereits ohne die Differenzierung in die verschiedenen Subtypen, recht komplex ist, wird auf diesen Umstand an dieser Stelle nur hingewiesen und im restlichen Text auf die Unterscheidung verzichtet.
Thrombosemechanismen
Thrombosen durch positiv geladene LNPs
Eigentlich sollten die verwendeten LNP mit -3,13 mV leicht negativ geladen sein, wie aus dem EMA-Leak mittlerweile hinlänglich bekannt ist, um exakt derartige Nebenwirkungen, wie Thrombosen oder fehlerhafte Lokalisierung, zu vermeiden (https://factreview.gr/wp-content/uploads/2023/07/Rolling-Review-Report-Quality-COVID-19-mRNA-Vaccine-BioNTech.pdf). Der sogenannte Zeta-Wert wird jedoch bei den kommerziellen Chargen der COVID-Injektionen nicht mehr bestimmt, wie von der TGA (Therapeutic Goods Administration) ist eine Abteilung des australischen Gesundheitsministeriums, herausgeklagte Laboranalysen des europäischen OMCL (Official Medicines Control Laboratory) Sciensciano zeigen (https://www.tga.gov.au/sites/default/files/foi-3390-11.pdf).
Nanostrukturen sind jedoch schon seit Jahrzehnten im medizinischen Umfeld dafür bekannt dafür, dass sie Blutgerinnung auslösen allein aufgrund der Tatsache, dass es sich um Nanostrukturen handelt. Dabei reichen bereits beschichtete Schläuche oder anderweitig nanooptimierte Materialien.
Es gibt Versuche, diese gerinnungsinduzierenden Eigenschaften von Nanomaterialien medizinisch zu nutzen, indem man künstliche Blutplättchen herstellt. Diese synthetische Plättchen bestehen aus 170 nm kleinen mit einem kleinen Protein (Peptid) beschichteten Nanokügelchen, die entwickelt wurden um die Thrombozytenaggregation an Verletzungsstellen zu verstärken (https://www.futuremedicine.com/doi/full/10.2217/nnm.13.48). Man nutzt also seit einiger Zeit, mindestens seit 2013, in der Medizin durchaus auch bewusst die gerinnungsfördernden Eigenschaften von Nanomaterialien, die man jedoch bei den Covid-Injektionen komplett ignoriert hat.
Die meisten bisherigen Toxizitätsstudien über Nanopartikeln haben sich weitgehend auf 2 der 3 wichtigsten Abwehrsysteme des Blutplasmas konzentriert: Die Komplementproteine des angeborenen Immunsystems und Antikörper. Das 3. Abwehrsystem, die Blutgerinnung, wurde vernachlässigt, obwohl es bei unbeabsichtigter Aktivierung die akutesten und ebenfalls teilweise tödliche Folgen hat.
Das Blut hat sich evolutionär mit absicht so entwickelt, dass es aktiv gerinnt, wenn es in Kontakt mit Fremdoberflächen kommt, besonders, wenn diese Oberflächen geladen sind. Bei der Injektion von Nanopartikeln, wie LNPs, wird das Blut großen Mengen an fremden Oberflächen ausgesetzt. Die Oberfläche von Nanostrukturen ist zudem aufgrund ihrer Nanostrukturen im Verhältnis zu ihrem Volumen immens größer als man das von normalen Strukturen des täglichen Lebens kennt.
Diese Nanopartikel können daher durch ihre Nanostruktur, die vollkommen andere physikalische Eigenschaften hat als jene von Nicht-Nanostrukturen, wie Grenzflächeneffekte und Ladungseffekte, indirekt die Gerinnung aktivieren, indem sie mit Zellen interagieren, welche die Gerinnungsprozesse beeinflussen, wie z. B. Endothelzellen, Neutrophile und Blutplättchen.
Das kann dadurch geschehen, dass sie LNP über Grenzflächeneffekte eine sogenannte Proteincorona aus Körpereigenen Proteinen zulegen, wie man das von Onpattro kennt, mit welchem BioNTech/Pfizer ihre Produkt bei der Zulassung verglichen haben, um keine Toxikologischen Studien für ihr Lipidsystem durchführen zu müssen (https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf).
Nur ein Bruchteil der Serumproteine des menschlichen Blutes wurden auf die Eigenschaft, eine Proteincorona um LNPs zu bilden, untersucht (https://doi.org/10.1021/acs.bioconjchem.0c00366). Welche Proteine eine solche Corona um Comirnaty oder Spikevax bilden ist aktuell unbekannt und entsprechende Studien wurden von den Herstellern nicht veröffentlicht.
Diese Proteincorona kann von Mensch zu Mensch unterschiedlich sein. Welchen Einfluss das auf mögliche Nebenwirkungen die unterschiedliche Zusammensetzung der Proteincorona hat, ist aktuell unbekannt, da die Hersteller hierzu keine Studien vorgelegt haben und die Existenz der Proteincorona bei den Zulassungsbehörden komplett unterschlagen haben.
Viren sind in diesem Zusammenhang ebenfalls als Nanostrukturen zu betrachten und können aufgrund ihrer nahezu identischen Größe zu LNPs, die gleichen Effekte auslösen. Auch von Viren ist bekannt, dass sie sich, um sich vor dem Immunsystem zu tarnen, eine Proteincorona zulegen (https:/doi.org/10.1038/s41467-019-10192-2).
Proteine können ihre Struktur und Form verändern, wenn sie an die Oberfläche von Nanostrukturen binden. Das kennt man aus dem Labor seit langen als Effekt, wenn man Proteine an Plastikwaren oder Säulenmaterialien koppelt und das Experiment nicht so funktioniert, wie man sich das gedacht hatte, weil das Protein sich verbogen hat oder nicht in der Orientierung gebunden hat, die man gebraucht hätte. Aggregate von Proteinen auf Oberflächen verhalten sich nicht so wie Proteine in Lösung, einschließlich der Verursachung immunogener oder thrombotischer Nebeneffekte.
Die Struktur der Nanooberfläche, an die ein Protein bindet, hat Einfluss auf seine Struktur und somit seine Eigenschaften. Das gilt auch für das Blutgerinnungssystem.
Das wusste man alles bereits 2013 (https://www.futuremedicine.com/doi/10.2217/nnm.13.48)
Es kann also sein, dass Proteine, die als Corona an die LNPs gebunden haben an Fibrinogen binden und dieses aktivieren. Es kann aber auch sein, dass Fibrinogen selbst als der Corona des LNP in seine aktivierte Form übergeht und so die Gerinnungskaskade auslöst. Es ist bekannt, dass solches oberflächengebundenes Fibrinogen/Fibrin an GPIIB/IIIA auf Thrombozyten binden, wodurch diese immobilisiert und aktiviert werden (https://pubmed.ncbi.nlm.nih.gov/37546837/).
Fibrinogen ist ein lösliches Protein, das im Blutplasma vorkommt. Wenn Fibrinogen durch Thrombin gespalten wird, verändert Fibrinogen seine Konformation und aggregiert zu Fibrinsträngen, die wiederum das gerinnungsstabilisierende Netz bilden. Fibrinogen/Fibrin-Aggregate auf Oberflächen können die Adhäsion und Aktivierung von Blutplättchen verursachen. Studien haben die Exposition bestimmter Fibrinogenreste mit verschiedenen Nebenwirkungen in Verbindung gebracht (https://pubmed.ncbi.nlm.nih.gov/37546837/). So interagiert beispielsweise die durch Nanopartikel hervorgerufene Exposition einer Peptidsequenz am C-Terminus der γ-Kette des Fibrinogens mit dem Integrinrezeptor Mac-1 und induziert Entzündungen (https://www.nature.com/articles/nnano.2010.250). Man hätte hiermit somit auch einen potentiellen Entzündungsmechanismus zusätzlich zum thrombotischen Mechanismus.
https://www.futuremedicine.com/doi/full/10.2217/nnm.13.49)
Die Ladung der Nanopartikel spielt aber noch eine große Rolle in der Pathophysiologie der NLPs. Sie bestimmt den Ort, an den die Partikel hauptsächlich gelangen. Negativ geladenen LNP landen häufig in der Milz, positiv geladene LNPs reichern sich in der Regel in der Lunge und in den Blutgefäßen an (https://pubmed.ncbi.nlm.nih.gov/37546837/). Luftübertragene Viren sind daher aus evolutionären Gründen ebenfalls positiv geladen, um sicherzustellen, dass sie in der Lunge enden.
Negativ geladene LNPs können in den Covid-Injektionen dadurch entstehen, dass diese mit zu viel DNA-Verunreinigungen beladen sind. Das Phosphatrückgrad der DNA ist negativ geladen.
Positiv geladene LNPs können in den Covid-Injektionen dadurch entstehen, dass sie nicht beladen wurden, also leer sind, da die modRNA mit ihrer negativen Ladung (geringer negativ als jene von DNA), die positive Ladung der kationischen Nanolipide im Optimalfall ausbalanciert.
Eine Covid-Injektion basierend auf LNP-Technologie, kann aus einer Mischung von Varianten bestehen, von denen einige Partikel negativ und einige Partikel positiv geladen sind. Da das Zeta-Potential der verwendeten Chargen nicht gemessen wurde, muss man davon ausgehen, dass die Ladungen der verschiedenen Chargen, in Abhängigkeit der Verunreinigung und Formulierung, stark geschwankt haben können.
Die Formulierung wurde von 4 verschiedenen Herstellern vorgenommen: Polymum, Dermapharm/Mibe, Allergopharma, Pharmacia & Upjohn Company LLC (https://drbine.substack.com/p/liste-der-biontech-zulieferer-work), die vorher keinerlei Erfahrungen mit dieser Wirkstoffklasse hatten.
Eine Studie, welche eine Identität des Produktes, die Homogenität der LNPs oder die identische Größe nach Herstellung durch 4 verschiedene Fomulierungstätten belegt, wurde nicht durchgeführt.
Die Auswirkungen von Liposomen auf die Blutgerinnung werden jedoch auch als ladungsabhängig angesehen. Es wurde bereits 2013 vermutet, dass anionische (negativ geladene) Liposomen direkt mit Blutplättchen interagieren, während ihre kationischen (positiv geladenen) Gegenstücke indirekt durch Interaktion mit Plasmagerinnungsfaktoren wirken. Die direkte Wechselwirkung von Liposomen mit Blutzellen, einschließlich Thrombozyten, wurde bei verschiedenen Liposomenarten beobachtet und erwies sich als dosisabhängig. Die beobachteten Wechselwirkungen können auf die Internalisierung von Liposomen oder die Fusion von Zell- und Liposomenmembranen zurückzuführen sein. Es wird vermutet, dass Wechselwirkungen zwischen Liposomen und Blutplättchen für die nach Verabreichung negativ geladener Liposomen beobachtete Thrombozytopenie verantwortlich sind. Elektrostatische Wechselwirkungen zwischen kationischen Liposomen und anionischen Zellmembranen wurden als ein Mechanismus für die Verabreichung von Arzneimitteln in Endothelzellen angesehen. So wurde beispielsweise nachgewiesen, dass Endothelzellen kationische Liposomen aufnehmen und in der perinukleären Region anreichern können. Die am positivsten geladenen Liposomen wiesen die höchste Aufnahmequote auf. Dieser Mechanismus kann somit auch dazu beitragen, die Gefäße zu zerstören, wie das von vielen Pathologen mittlerweile nachgewiesen wurde. Die Schädigung von Endothelzellen geht jedoch auch mit der Freisetzung gerinnungsfördernder Signale einher und kann zu unerwünschten thrombotischen Ergebnissen führen und zu einer Endotheliits, einer Entzündung der Innenauskleidung der Blutgefäße. (https://www.futuremedicine.com/doi/full/10.2217/nnm.13.49)
Aktivierung des cGAS-STING pathway durch dsDNA-Verunreinigungen
Die Grundlagen zum cGAS-STING pathway findet man bei Wikipdia (https://en.wikipedia.org/wiki/CGAS%E2%80%93STING_cytosolic_DNA_sensing_pathway):
„Der cGAS-STING-Stoffwechselweg ist eine Komponente des angeborenen Immunsystems, die das Vorhandensein von zytosolischer DNA erkennt und als Reaktion darauf die Expression von Entzündungsgenen auslöst, die zur Seneszenz (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5468617/) oder zur Aktivierung von Abwehrmechanismen führen können. Die DNA befindet sich normalerweise im Zellkern. Die Lokalisierung der DNA im Zytosol wird mit der Tumorentstehung, viralen Infektionen und der Invasion einiger intrazellulärer Bakterien in Verbindung gebracht (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4466081/) Der cGAS-STING-Signalweg dient dazu, zytosolische DNA zu erkennen, und eine Immunantwort auszulösen. […]
Das angeborene Immunsystem stützt sich auf in der Keimbahn kodierte Mustererkennungsrezeptoren (Pattern Recognition Receptors, PRRs), um bestimmte pathogen-assoziierte molekulare Muster (PAMPs) zu erkennen. Nach der Erkennung eines PAMPs setzen PRRs Signalkaskaden in Gang, die zur Transkription von Genen führen, die mit der Immunantwort in Verbindung stehen. Da alle Krankheitserreger Nukleinsäure zur Vermehrung nutzen, können DNA und RNA von PRRs erkannt werden, um eine Immunaktivierung auszulösen. In normalen Zellen ist die DNA auf den Zellkern oder die Mitochondrien beschränkt. Das Vorhandensein von DNA im Zytosol deutet auf eine Zellschädigung oder Infektion hin und führt zur Aktivierung von Genen, die mit der Immunreaktion in Verbindung stehen.“
Das Problem ist im Übrigen BioNTech sehr wohl bekannt!
"Das Immunsystem des Wirts erkennt virale Infektionen und reagiert darauf. Schlüsselreaktionen des angeborenen Immunsystems bei der Virenabwehr sind Mustererkennungsrezeptoren (PRRs), die auf virale genomische DNA und RNA, wie einzelsträngige RNA (ssRNA) und doppelsträngige RNA (dsRNA), abzielen. (m)RNA-basierte Impfstoffe und Therapeutika aktivieren das Immunsystem über dieselben Mechanismen, die auf der Erkennung von PRRs beruhen." (https://pubmed.ncbi.nlm.nih.gov/34068715/).
Man musste also bei BioNTech/Pfizer sehr genau wissen, dass DNA-Verunreinigungen diese PRRs und somit den cGAS-STING pathway aktivieren würden, hat aber dennoch auf eine vollständige Entfernung dieser problematischen Reste mit der Goldstandardmethode bewusst aus Umweltschutzgründen verzichtet:
"So gilt beispielsweise die Ionenpaar-Umkehrphasen-Hochleistungsflüssigkeitschromatographie (HPLC) nach wie vor als Goldstandard-Methode für die Entfernung unerwünschter Nebenprodukte/Verunreinigungen aus der mRNA von Interesse. Leider lässt sich die HPLC für die Herstellung großer Mengen mRNA nur schwer skalieren und würde zu großen Mengen an gefährlichem Abfall führen. Daher wurde kürzlich die Cellulose-Chromatographie entwickelt. Diese Methode zeigte eine große Effizienz bei der Abreicherung von dsRNA-Verunreinigungen und der Herstellung von mRNAs mit hoher Reinheit und geringem Immunaktivierungspotenzial." (https://pubmed.ncbi.nlm.nih.gov/34068715/).
Diese von BioNTech neu entwickelte Methode, die wahrscheinlich nicht validiert war gegen den bisherigen Goldstandard als Referenz, hat anschließend offensichtlich kläglich versagt, abgesehen vom Anfängerfehler, sich beim DNAse I Verdau nicht an die Vorgaben des Herstellers zu halten (https://www.thermofisher.com/de/de/home/references/ambion-tech-support/nuclease-enzymes/general-articles/dnase-i-demystified.html) und den Verdau zu kurz (25-35 min) laufen zu lassen (EMA-Leak “M3 20 Nov 2020 FDA Query Responses“ S.2.2.4. In Vitro Transcription (IVT)), obwohl die Reaktionszeit, laut Hersteller, abhängig von der Menge der Kontamination ist.
Mehr Details zum Herstellungsprozess findet man in diesem Artikel:
Nun ist es leider so, dass die EMA-Unterlagen sehr deutlich zeigen, dass die Produkte mit DNA-verunreinigt sind, weil der DNAse I-Verdau nicht funktioniert hat und BioNTech/Pfizer das Problem auch nie in den Griff bekommen haben. Daher wurde einfach mit bekannter DNA-Verunreinigung und nicht bestandener GMP-Prüfung weiter produziert.
Erklärung und Übersetzung der wichtigen Stelle der EMA-Dokumente:
https://drbine.substack.com/p/die-ema-wei-dass-der-dnase-i-verdau
Die vollständigen Dokumente + Korrespondenz: https://mega.nz/folder/WQo2QDaa#xp50i-ducJCz8cCHtq2AFg
In einem (umstrittenen) Preprint, wird die DNA-Verunreinigung in USA und Kanada nachgewiesen (https://osf.io/preprints/osf/mjc97). Des Weiteren gibt es entsprechende Hinweise auch in Deutschland durch das MMD Labor in Magdeburg (https://t.me/HolgerFischerRA/8672), welches die ebenfalls vom belgischen OMCL Labor Sciensciano verwendete und somit validierte Nachweismethode der Fluorometrie verwendete (https://www.tga.gov.au/sites/default/files/foi-3390-11.pdf).
Was bedeutet das für die hier behandelten Thrombosen?
Es sieht aktuell so aus, dass über die Aktivierung des cGAS-STING pathways durch DNA-Verunreinigungen, dies zu einem ischämischer Schlaganfall durch Blutgerinnsel führen kann (https://www.frontiersin.org/articles/10.3389/fimmu.2023.1275408/full). Die Hinweise, dass die modRNA-Injektionen das Risiko für einen Schlafanfall erhöhen, sind bereits seit längerem veröffentlicht:
Die Kohorte umfasste 4 139 888 Personen, 49,8 % Frauen und 6,7 % waren ≥80 Jahre alt. Während der ersten 28 Tage nach einer mRNA-Impfung erlitten 2104 Personen einen Schlaganfall (82 % ischämische Schlaganfälle, 13 % intrazerebrale Blutungen und 5 % Subarachnoidalblutungen). (https://pubmed.ncbi.nlm.nih.gov/36994734/). Und ja, das passiert auch beim Produkt von AstraZeneca (https://jnnp.bmj.com/content/92/11/1247), weil dieses MASSIV verunreinigt war (https://elifesciences.org/articles/78513). Auf DNA Verunreinigen hin hat man das AstraZeneca Produkt leider nicht untersucht. Bei so massiven Proteinverunreinigungen sind aber DNA-Verunreinigungen nicht auszuschließen.
Und ja, die modRNA-Produkte überschreiten die Blut-Hirn-Schranke, denn diese Art kationische Nanocarrier wurde ursprünglich für die Behandlung von Hirntumoren entwickelt (https://onlinelibrary.wiley.com/doi/full/10.1002/brx2.7 und https://pubmed.ncbi.nlm.nih.gov/29886842/). Dafür muss die Blut-Hirn-Schranke überwunden werden.
“Das Erkennen von DNA durch cGAS ist von der DNA-Länge abhängig. Doppelsträngige DNA (dsDNA), die länger als 20 bp ist, aktiviert cGAS, induziert die Dimerisierung von cGAS und führt zur Bildung eines 2:2-DNA/cGAS-Komplexes, während dsDNA mit weniger als 20 bp nicht in der Lage ist, die Dimerisierung und Aktivierung von cGAS zu induzieren”. (https://link.springer.com/article/10.1007/s12272-023-01452-3).
Die dsDNA-Fragmente in den modRNA-Produkten sind um die 100-120 Basenpaare lang.
Dieses oben erwähnte Paper hat auch ein (un-)übersichtliches Schaubild, was bei der Aktivierung von cGas durch dsDNA passiert:
Und an dieser Stelle haben wir eine Überschneidung zu Autoimmunerkrankungen. Ein fließender Übergang.
Eine weitere Möglichkeit den cGAS-STING pathway zu aktivieren ist das Endoplasmatische Retikulum mit zu viel Spike-Protein-Produktion zu stressen. Das aktiviert über cGAS-STING auch eine Autoimmunreaktion.
EN: „Altogether, our study demonstrates a novel mechanism by which large repeat expansions cause chronic endoplasmic reticulum stress and associated mtDNA leakage. This mtDNA is, in turn, sensed by the cGAS/STING pathway and induces a type-I IFN response predisposing to autoimmunity. Elucidating this pathway reveals new potential therapeutic targets for autoimmune disorders associated with repeat expansion diseases.“
DE: „Insgesamt zeigt unsere Studie einen neuen Mechanismus, durch den große Wiederholungsexpansionen chronischen endoplasmatischen Retikulumstress und damit verbundenen mtDNA-Austritt verursachen. Diese mtDNA wird wiederum durch den cGAS/STING-Signalweg erkannt und löst eine Typ-I-IFN-Reaktion aus, die zu Autoimmunität führt. Die Aufklärung dieses Weges eröffnet neue potenzielle therapeutische Ansatzpunkte für Autoimmunerkrankungen, die mit der Wiederholungsexpansion in Zusammenhang stehen.“
„Chronischer ER-Stress führt zu ATF6-abhängiger mitochondrialer DNA-Freisetzung, ROS-Produktion und einer cGAS-STING-abhängigen Hochregulierung von Typ I IFN und ISGs.“
(https://pubmed.ncbi.nlm.nih.gov/38378748/),
Nun ist es jedoch so.
1. Das Spike-Protein wird laut BioNTech eigenen Unterlagen im Endoplasmatischen Retikulum produziert (ER) (https://www.tga.gov.au/sites/default/files/foi-2389-03-1.pdf und tga.gov.au/sites/default/files/foi-2389-06.pdf)
2. Es konnte mittels Raman-Spektroskopie auf zellulärer Ebene gezeigt werden, dass das ER nach der modRNA-Impfung Schaden nimmt (https://www.biorxiv.org/content/10.1101/2022.03.02.482639v1.full.pdf). Dieses Ergebnis verwirrte die Autoren der Studie, da diese fest davon ausgingen, dass das Spike-Protein im Zytosol produziert wird, was falsch ist. Umso zuverlässiger ist deren somit kontraintuitive Messung, die der Hypothese der Autoren widerspricht. Mit dem Wissen, dass das Spike-Protein im ER produziert wird, ist die Messung schlüssig.
3. Der durch den Stress durch permanente Spike-Produktion in hoher Konzentration im ER verursachte Austritt von mtRNA führt zu einer Autoimmunreaktion in Muskelzellen, wie Prof. Hartmann selbst belegt. Diesmal nicht wegen eines genetischen Defekts, sondern wegen eines erworbenen ER-Stresses, der sich über Jahre hinziehen kann, da die Spike-Produktion bei vielen Menschen mit Muskelabbau immer noch aktiv ist und nicht stoppt.
4. Dieser Autoimmunangriff kann somit theoretisch in jedem Zelltyp passieren, der unter dauerhaftem ER-Stress leidet. Es handelt sich hiermit um einen weiteren Mechanismus für Autoimmunität.
Des Weiteren wird cGAS-STING aktiviert, das zieht ein Thromboserisiko nach sich siehe “Aktivierung des cGAS-STING pathway durch dsDNA-Verunreinigungen”. Wir hätten hier als einen weiteren Thrombosemechanismus.
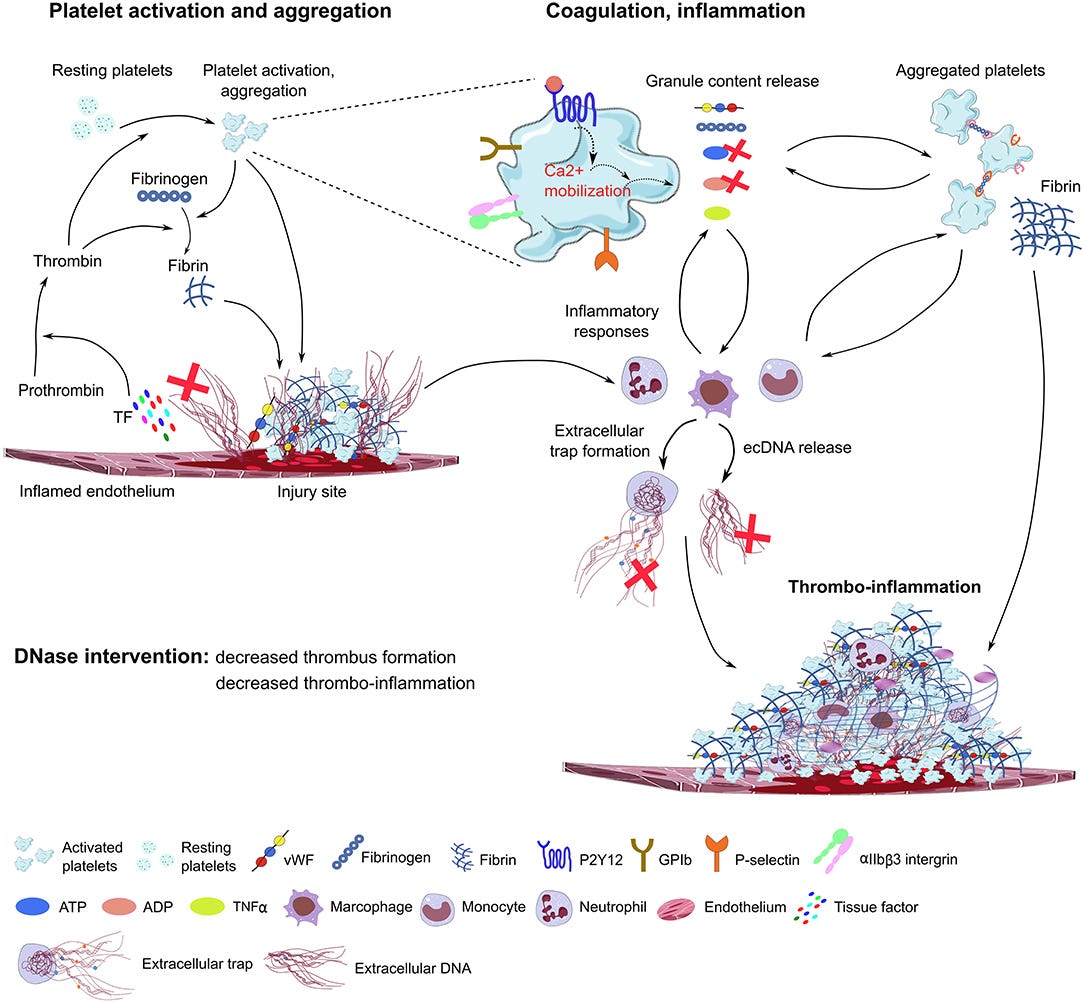
Extrazelluläre DNA - ein Gefahrensignal, das Immunthrombosen auslöst
“Extrazelluläre Desoxyribonukleinsäure (DNS) war ein bisher unerkannter zellulärer Bestandteil des Blutes, der tiefgreifende proinflammatorische und prothrombotische Wirkungen hervorruft.” (https://www.frontiersin.org/articles/10.3389/fimmu.2020.568513/full)
Mehr braucht man eigentlich zu diesem Paper nicht mehr sagen. Die Überschrift und dieser eine Satz sagen bereits alles. Wenn freie DNA im Blut ist, führt das zu einer Entzündung und kann eine Thrombose hervorrufen. Wenn also, nicht verpackte, nachte dsDNA in einer Injektion vorhanden ist, kann die nackte DNA, weil sie ins Blut geraten ist, bereits eine Thrombose auslösen.
Ich liebe es, wenn Paper eindeutig sind und man sie einfach direkt zitieren kann. Mehr ist zu diesem Thema nicht zu sagen, schätze ich.
“Extrazelluläre DNA kann direkt die Fibrinbildung induzieren und dadurch das Thrombuswachstum fördern.”
Lustigerweise schlägt man in dieser Publikation DNase I als Therapeutikum vor, deren nicht funktionieren in der Produktion des BioNTech/Pfizer Produktes, das Problem erst verursacht hat.
DNA kann aber auch aus den Körperzellen freigesetzt werden, wenn diese, aufgrund eines Autoimmunangriffs zerstört werden.
a) Wenn Zellen Spike-Protein produzierten und Bruchstücke dieses körperfremden Proteins auf MHC-Proteinen präsentiert werden sie durch T-Killerzellen zerstört, wodurch möglicherweise auch die DNA dieser Zellen freigesetzt wird.
b) Der Autoimmunangriff kann auch dadurch passieren, dass die Zelle das Spike-Protein an ihrer Oberfläche präsentiert, Antikörper daran bindn und damit das Komplement System aktiviert wurde, welches anschließend diese Zelle zerstört hat. Dadurch wird möglicherweise DNA freigesetzt.
Sollte die Spike-Produktion oder das modRNA-Produkt die Zelle über eine Mitochondriopathie oder ein wie auch immer geartetes Signal (z. Bsp. über p53) in die Apoptose (den kontrollierten Selbstmord) geschickt haben, könnte auch da DNA freigesetzt werden.
Bei einzelnen Zellen im Normalfall kein Problem. Es sollte genug DNase im Körper vorhanden sein, das im Griff zu behalten. Bei der Menge an Zellen, die das nach den Covid-Injektionen betroffen haben könnte, schon aufgrund der Menge der betroffenen Zellen problematisch zusätzlich zu den vorhandenen DNA-Verunreinigungen in den Produkten selbst.
Doppelstrangige DNA (dsDNA) induziert einen prothrombotischen Phänotyp im Gefäßendothel
Virale oder endogene dsDNA sind Gefahrensignale für das Immunsystem. Sie induzieren daher als Abwehrreaktion einen prothrombotischen Phänotyp im vaskulären Endothel aber nur in Gegenwart positiv geladener Strukturen wie Viren oder Lipiden. Das stellt möglicherweise sicher, dass diese Abwehrmechanismen nur bei einem Pathogen aktiviert werden, welches meist positiv geladen ist, und nicht aus versehen bei dsDNA die anderweitig freigesetzt wurde. In dieser Studie https://www.nature.com/articles/s41598-017-01148-x) “konnte gezeigt werden, dass doppelsträngige DNA sowohl in Zellen als auch in Mäusen in Gegenwart von positiv geladenen Lipiden eine schnellere Blutgerinnung verursacht. Die Studie zeigte direkte prothrombotische Effekte von intrazellulärer doppelsträngiger DNA (dsDNA) im vaskulären Endothel indem die dsDNA zu einer Hochregulierung der prokoagulatorischen Proteine Tissue Factor und PAI-1 und einer erhöhten Oberflächenexpression von vWF (von Willebrand Faktor) führte. Die Oberflächenexpression von vWF und führte schließlich zu einer beschleunigten Blutgerinnung in vitro und Thrombusbildung in einem Modell für Endothelverletzungen in vivo. dsDNA, kann (in Gegenwart positiv geladener Nanostrukturen) pro-inflammatorische Effekte in Endothelzellen induzieren, was zu einer Hochregulierung von Entzündungszytokinen wie IL-6, IL-8, MCP-1, RANTES, IP-10 und IFN-β, sowie der Adhäsionsmoleküle ICAM-1 und VCAM-1 auf menschlichen Endothelzellen führt. Darüber hinaus wurde beschrieben, dass dsDNA die Freisetzung von TNFα aus Endothelzellen induziert und dadurch die Adhäsion von Leukozyten zu fördern. Ähnliche Wirkungen wurden auch bei glomerulären Endothelzellen beobachtet wo dsDNA die Albuminpermeabilität funktionell erhöhte.”
Es wäre also denkbar, das das auch durch die dsDNA-Verunreinigungen in den modRNA-Produkten passieren könnte.
(https://christiegrace.substack.com/p/ds-dna-causes-rapid-clot-formation)
Es gibt zu diesem Sachverhalt sogar noch ein Paper, das Christie ausgegraben hat und schön erklärt (Double-stranded DNA induces a prothrombotic phenotype in the vascular endothelium - PMC (nih.gov)).
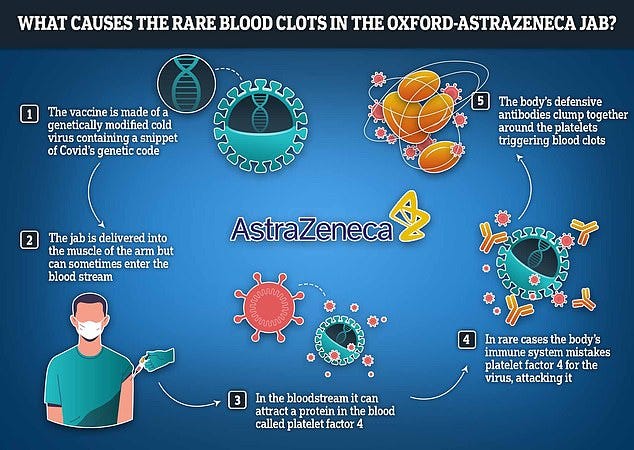
Aktivierung des Plättchenfaktors PF4
Der Plättchenfaktor PF4 kann von den verschiedenen Covid-Injektionen auf unterschiedliche Weise aktiviert werden:
Adenovirenprodukte:
Die Stimulation des Immunsystems durch die Impfung aktiviert Anti-PF4 Antikörper, die mit PF4 und Thrombozyten reagieren (VITT Syndroms). Dies wurde vor allem für die COVID-19-Impfung von AstraZeneca gezeigt und mach schloss daher auf eine Wechselwirkung zwischen dem Impfstoff und Blutplättchen oder dem Impfstoff und PF4 (https://www.degruyter.com/document/doi/10.1515/biol-2022-0035/html).
Die Affinität des Adenovirus für PF4 ist von Natur aus bereits hoch und kann daher Blutplättchen aktivieren. Ausgehend von diesen Erkenntnissen können auch andere Adenovirus-Impfstoffe wie Janssen (J&J) und Sputnik V VITT auslösen (https://www.degruyter.com/document/doi/10.1515/biol-2022-0035/html).
Astra hat das Problem mittlerweile auch im UK Mainstream zugegeben (https://www.dailymail.co.uk/health/article-13361271/AstraZeneca-admits-Covid-vaccine-cause-rare-blood-clotting-effect-legal-fight-victims-defective-jab.html)
Gemeinsame Mechanismen der Adenovirenprodukte und modRNA-Produkte
Sowohl auf Adenovirusvektoren basierende Produkte als auch auf modRNA basierende Produkte induzieren die Spike-Protein-Produktion, die zur Freisetzung des Plättchenfaktors 4 (PF4) aus den Blutplättchen führt. Im Falle des vektorisierten Impfstoffs bindet die DNA oder andere Substanzen des Adenovirus an den PF4 als Polyanion und bildet einen PF4/Polyanion-Komplex. Dies kann theoretisch auch durch die DNA-Verunreinigungen durch den subtoptimalen Produktionsprozess der modRNA-Produkte passieren, da bis dato selbst BioNTech/Pfizer der exakte immunologische Mechanismus, der für Schutz gegen SARS-COV-2 verantwortlich ist, ist unbekannt ist (https://www.fda.gov/media/151733/download (S. 15)).
ModRNA-Produkte
Freie dsDNA, die als Verunreinigungen durch den suboptimalen Herstellungsprozess in der modRNA Impfung von Moderna und BioNTEch/Pfizer als Verunreinigung verblieben sind, könnte ebenfalls eine Ursache für diese PF4-reaktiven Antikörper sein. Es wurde nachgewiesen, dass DNA und RNA multimolekulare PF4-Komplexe bilden, die Antikörper gegen Heparin-induzierte Thrombozytopenie binden und so Antikörper induzieren. (https://pubmed.ncbi.nlm.nih.gov/35084333/ , https://www.degruyter.com/document/doi/10.1515/biol-2022-0035/html).
Nach den Konformationsänderungen verursacht PF4 Antigenität, und es kommt zur Bildung von Anti-PF4/Polyanion-Antikörpern, die zu einer impfstoffinduzierten immunthrombotischen Thrombozytopenie (VITT)/Thrombose mit Thrombozytopenie-Syndrom (TTS) führen. (https://www.sciencedirect.com/science/article/pii/S105017382200038X?via%3Dihub)
Das Spike-Protein selbst führt zu Thrombosen
Ein wesentlicher Zusammenhang zwischen dem SARS-COV2-Spike-Protein selbst und Thrombosen könnte darin bestehen, dass das freie Spike-Protein, welches nachweislich negative Auswirkungen auf die Endothelzellen hat, zu schwere Entzündungsreaktion des Endothels führt, welche Thrombosen auslösen können (https://pubmed.ncbi.nlm.nih.gov/35084333/, https://www.degruyter.com/document/doi/10.1515/biol-2022-0035/html).
Das SARS-CoV-2-Spike-Protein 1 (S1) aktiviert mikrovaskuläre Endothelzellen
und das Komplementsystem, was zur Aggregation von Blutplättchen führt. Das von SARS-CoV-2 abgeleitete S1 reicht aus, um entzündliche und thrombogene Prozesse in der Mikrovaskulatur auszulösen, die durch das Komplementsystem verstärkt werden und die thromboembolischen Komplikationen verstärken. (https://pubmed.ncbi.nlm.nih.gov/35320941/).
Zudem ist es bekannt, dass das Spike-Protein an den ACE2-Rezeptor bindet, welcher auch auf Monocyten, Makrophagen, Blutplättchen und Endothelzellen exprimiert wird. Das Binden des Spike-Proteins an ACE2-Rezeptoren der Endothelzellen bringt diese dazu, gerinnungsfördernd und thrombenbildend zu reagieren. Es wurde gezeigt, dass das Spike-Protein zudem die Bindung von Antithrombin und Heparin-Cofaktor II an Heparansulfat der endothelialen Glykokalyx kompetitiv hemmen kann, was zu einer erhöhten Thrombogenität führt. (https://pubmed.ncbi.nlm.nih.gov/35202800/ )
“Das Spike-Protein verschiedener SARS-CoV-2-Varianten hemmt den Tissue Factor (TF) Pathway Inhibitor (TFPI), den primären Regulator des extrinsischen Weges der Blutgerinnung. Gleichzeitig induziert das Spike-Protein die transkriptionelle Hochregulierung von TF und erhöht die Expression und Sekretion von Gerinnungsfaktor V und Thrombin. Darüber hinaus interagiert das Spike-Protein stark mit dem menschlichen Östrogenrezeptor α (ERα), was möglicherweise zur Hochregulierung von zirkulierenden Faktoren beiträgt, die an der Gerinnung/Fibrinolyse beteiligt sind, wie z. B. Gerinnungsfaktor V. Schließlich führt die direkte Bindung des Spike-Proteins an das Angiotensin-konvertierende Enzym 2 (ACE2) zur Inaktivierung der Adenosinmonophosphat-aktivierten Proteinkinase (AMPK), einem der Schlüsselmoleküle zur Regulierung der mitochondrialen Funktionen und Biogenese. Veränderungen in den Mitochondrien führen zu einer anhaltenden Stoffwechselstörung in Endothelzellen, die den hyperkoagulierbaren Zustand durch Hochregulierung des Gerinnungsfaktors Xa weiter verändert.”
“Das Spike-Protein von SARS-CoV-2 kann nachweislich alle drei Wege des Komplementsystems aktivieren. SARS-CoV-2 aktiviert den Lektin-Weg über die Mannan-bindenden Lektin-Serin-Proteasen 1 und 2 (MASP1/2). Im klassischen Weg wird das Komplementsystem durch Antikörper gegen das Spike-Antigen über den C1-Komplex aktiviert. Schließlich verstärkt der Abbau von komplementregulatorischen Proteinen auf infizierten Endothelzellen, wie CD46, CD55 und CD59, den C3-Tick-Over im alternativen Weg. Die Aktivierung aller drei Komplementwege konvergiert in den C3- und C5-Konvertasen, die C3 und C5 erzeugen. Der letzte Teil der Aktivierung des Komplementsystems gipfelt in der Bildung des Membranangriffskomplexes (MAC), der die Lyse infizierter Zellen auslöst und zur Aktivierung und Verletzung des Endothels, zur Koagulopathie und zur Thrombose beiträgt. Während der MAC-Bildung werden die Anaphylatoxine C3a und C5a gebildet und können ihre entsprechenden Rezeptoren, C3aR und C5aR, aktivieren, die schließlich Neutrophile rekrutieren und den durch SARS-CoV-2 ausgelösten Entzündungszustand verstärken können. Neutrophile produzieren große Mengen an histotoxischen Mediatoren, einschließlich neutrophiler extrazellulärer Fallen (NETs), die letztlich zu einer Schädigung der Endothelzellen führen. Darüber hinaus begünstigt die Aktivierung von Endothelzellen durch die Bindung des Spike-Proteins von SARS-CoV-2 an das Angiotensin-konvertierende Enzym 2 (ACE2) die Exozytose von P-Selektin und von Willebrand-Faktor (vWF) aus Weibel-Palade-Körpern. Die Aktivierung der C5a/C5aR-Achse verstärkt die durch das RAS-ähnliche Proto-Onkogen A (RalA) vermittelte Exozytose von P-Selektin und vWF weiter. Die verstärkte Expression von P-Selektin ist entscheidend für die Adhäsion von Neutrophilen über den P-Selektin-Glykoprotein-Liganden 1 (PSGL-1) und ihre anschließende Extravasation in entzündete Gewebe. All diese Vorgänge führen zu einer massiven Thrombozytenbindung, Fibrinbildung und Gerinnung der roten Blutkörperchen (RBCs), was letztlich zu systemischer Thrombose und disseminierter intravasaler Gerinnung führt. Abkürzungen: TMPRSS2, Transmembranprotease Serin 2.”
(https://pubmed.ncbi.nlm.nih.gov/37393180/)
Aktivierung des Inflammasoms
Das SARS-CoV-2S-Protein aktiviert das NLRP3 Inflammasom und dereguliert Gerinnungsfaktoren in Endothel- und Immunzellen. (https://pubmed.ncbi.nlm.nih.gov/38225643/)
Auf Doccheck findet man die Definition von Inflammasom: “Als Inflammasom wird ein eukaryotischer Proteinkomplex bezeichnet, der sich innerhalb des Zytoplasmas nach inflammatorischen Signalen bildet. Er ist Teil der angeborenen Immunreaktion und führt zur Aktivierung von entzündungsspezifischen Interleukinen (https://flexikon.doccheck.com/de/Inflammasom).”
Bei Wikipedia findet man (noch) dir Grundlagen zum Inflammasom NLRP3:
NLRP3 ist ein Komplex aus mehreren Proteinen. Wie der Name “Inflammasom” schon sehr dezent andeutet, löst dieser Proteinkomplex Entzündungen aus.
Das Spike-Protein aktiviert NF-κB, einen wichtigen Regulator von Entzündungsreaktionen, und löst damit den NLRP3 Inflammasom-Signalweg aus.
NF-κB ist ein “Transkriptionsfaktor, der in praktisch allen tierischen Zelltypen und Geweben vorkommt. Über die Bindung an bestimmte regulatorische Abschnitte der DNA kann er die Transkription abhängiger Gene beeinflussen NF-κB[1] ist von großer Bedeutung für die Regulation der Immunantwort, der Zellproliferation und des Zelltodes. Die Aktivierung von NF-κB gilt als kritisch für die Entstehung von Entzündungen. Schließlich erfüllt NF-κB wichtige Funktionen im Bereich der Entwicklung des Immunsystems und der lymphatischen Organe. Die Rolle von NF-κB in anderen Zusammenhängen (z. B. im Nervensystem) ist Gegenstand gegenwärtiger Forschung.(https://de.wikipedia.org/wiki/NF-%CE%BAB).”
Die Aktivierung des Inflammasoms löst die Synthese und die Freisetzung proinflammatorischer Zytokine sowie Gerinnungsregulatoren aus. Das Spike-Protein scheint auch ein direkten Stimulator der Monozytenaktivierung (Monozyten sind Vorläuferzellen von Makrophagen, die sich im Blut befinden und somit Leukozyten sind) zu sein, indem es den NF-κB-Signalweg auslöst und Zytokine wie IL-6 freisetzt.
“Fig. 6 Das S-Protein als isoliertes Element aktiviert NF-κB, fördert die Freisetzung von pro-inflammatorischen Zytokinen und löst das Priming und die Aktivierung des NLRP3-Infammasom-Systems aus, was zur Bildung und Freisetzung von reifem IL-1β führt. Dieses Zytokin kann wiederum auf IL-1R einwirken und so eine autoinflammatorische Schleife anheizen und verstärken. Darüber hinaus steigert das S-Protein den zellulären Gehalt an Faktoren, die an Gerinnungsprozessen beteiligt sind, darunter vWF, FVIII und TF. In menschlichen Endothelzellen gelingt es dem S-Protein nicht, die Protease ADAMS-13 zu überexprimieren, um der hyperkoagulativen Kapazität von vWF-Multimeren entgegenzuwirken. Während diese Wirkungen des S-Proteins in menschlichen Monozyten durch TLR4 vermittelt werden, sind die beteiligten Rezeptoren in HUVEC noch nicht geklärt. Medikamente wie Anakinra, TAK242 (Resotorvid), MCC950 oder gerinnungshemmende Medikamente könnten die schädlichen entzündungsfördernden und gerinnungsfördernden Wirkungen des S-Proteins unterdrücken.” (https://pubmed.ncbi.nlm.nih.gov/38225643/)
LNP-mRNA kann das Inflammasom aktivieren
EN: „Inflammasome activation has recently been identified as a distinct innate immune system effect of LNP–mRNA.”
DE: „Kürzlich wurde die Aktivierung von Inflammasomen als eine besondere Wirkung von LNP-mRNA auf das angeborene Immunsystem identifiziert.“
LNP-mRNA aktiviert das Inflammasom. Makrophagen, die mit Lipopolysaccharid (LPS) oder mononukleären Zellen des peripheren Blutes (PBMCs) ohne vorherige Herausforderung geprimt wurden, aktivieren den nuklearen Faktor-κB (NF-κB) und induzieren die Produktion von pro-inflammatorischen IL-1-Zytokinen, zusammen mit anderen Molekülen, die im kanonischen Inflammasom-Aktivierungsweg vorhanden sind. Dazu gehören Caspase 1, Cathepsin B, das Adaptorprotein Apoptosis-associated specklike protein containing a CARD (ASC) specks, N-Gasdermin D (N-GSDMD) und mitochondriale reaktive Sauerstoffspezies (ROS). LNP-mRNA, in Lipid-Nanopartikeln formulierte mRNA; GSDMD NT, N-terminales Spaltprodukt von Gasdermin D; NLRP3, NOD-, LRR- und Pyrin-Domäne enthaltendes Protein 3; TLR4, Toll-like-Rezeptor 4. (https://pubmed.ncbi.nlm.nih.gov/38263456/)
Das Lipid selbst kann das Inflammasom aktivieren:
EN: “Notably, empty SM-102-based formulations also elicited strong IL-1β secretion, suggesting that these lipids provide both priming and activating signals for inflammasome activation.”
DE: „Bemerkenswerterweise lösten leere SM-102-basierte Formulierungen auch eine starke IL-1β-Sekretion aus, was darauf hindeutet, dass diese Lipide sowohl Initialisierungs- als auch Aktivierungssignale für die Inflammasom-Aktivierung liefern.“ (https://pubmed.ncbi.nlm.nih.gov/38263456/)
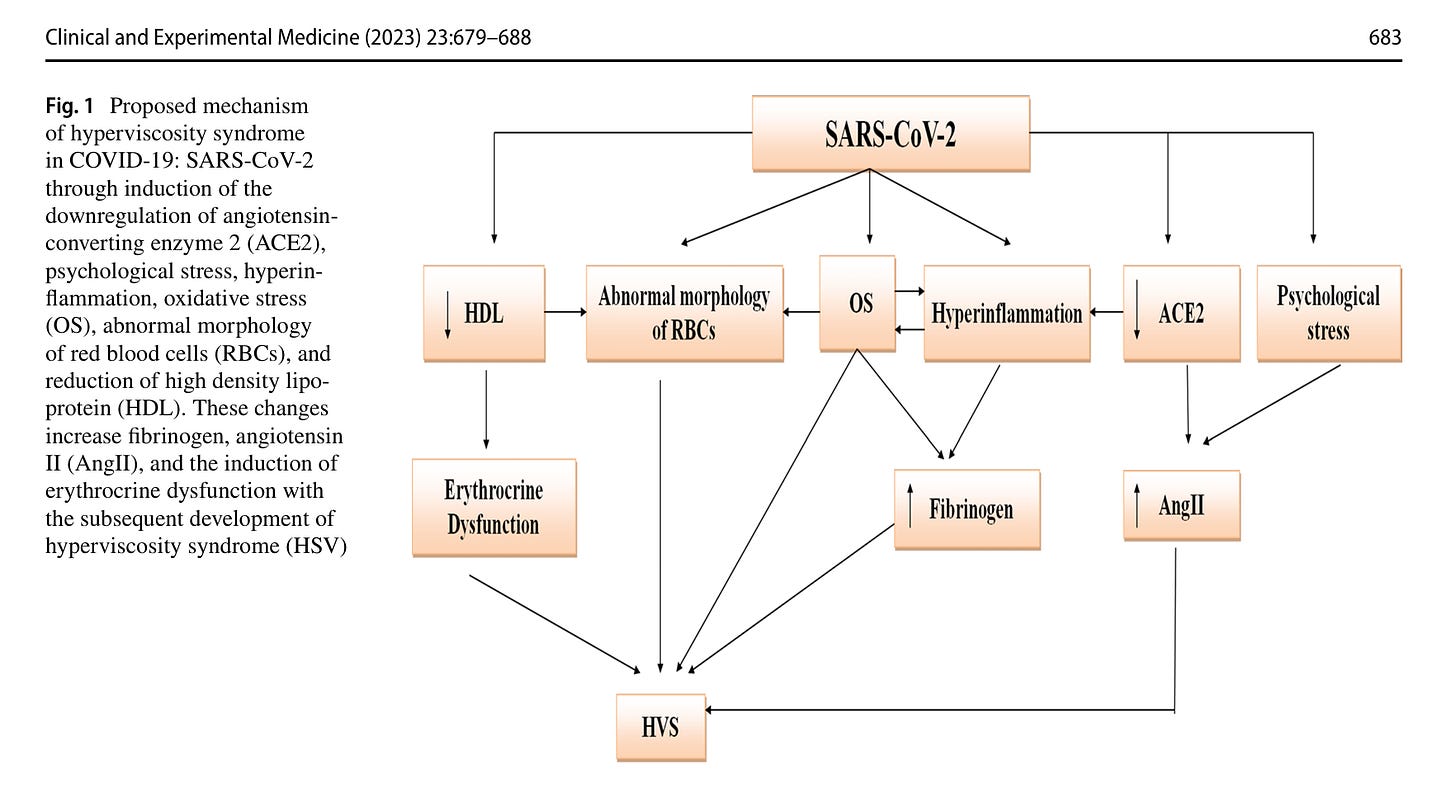
Erhöhte Blutviskosität
Thromben können sich auch spontan aufgrund erhöhter Blutviskosität bilden. Das entspräche der dritten Komponente der Virchowschen Trias: dem Blutfluss. Eine Erhöhung der Blutviskosität nach Covid-Injektion wurde schon sehr früh beobachtet (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8216419/ und ist zu einem bekannten Problem geworden https://pubmed.ncbi.nlm.nih.gov/35608715/).
SARS-CoV-2 = Spike Protein, weil es das Spike-Protein ist, das diese Probleme auch beim Virus verursacht.
(Seltene) Gendefekte/Genpolymorphismen
Bei diesen Gendefekten hätte eine Kontraiindikation der modRNA-Produkte bestanden, wäre meine Vermutung.
VEXAS syndrome
Das VEXAS-Syndrom ist ein kürzlich beschriebenes systemisches Entzündungssyndrom, das durch somatische Mutationen von UBA1 verursacht wird (https://www.thieme-connect.com/products/ejournals/pdf/10.1055/a-1887-5341.pdf). Somatische Mutation bedeutet, dass die Zellen diese Mutation nicht von Geburt an haben, sondern diese Mutation im Laufe des Lebens durch Fehler in der Zellteilung erwerben. Infektionen und Impfungen können Symptome auslösen oder verschlimmern bei Menschen, die bereits ein VEXAS-Syndrom entwickelt haben. Eine der Folgen der Verschlimmerung des VEXAS-Syndroms durch eine COVID-Injektion kann eine Thrombose sein neben vielen anderen bekannten Nebenwirkungen der Covid-Injektionen (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9891243/).
Das VEXAS Syndrom betrifft vor allem Männer über 50, die man vor der Injektion daraufhin hätte screenen müssen.
(https://www.thieme-connect.com/products/ejournals/pdf/10.1055/a-1887-5341.pdf).
Man hätte vor der Injektion Menschen mit einer UBA1 Mutation von der Injektion ausschließen/freistellen müssen durch z. Bsp. eine Impfunfähigkeitsbescheinigung. Das wurde jedoch unterlassen.
Aktuell müsste man sogenannte Long Covid/Post-Vac Patienten auf VEXAS hin untersuchen, um die VEXAS Patienten gesondert zu behandeln, da es sich bei VEXAS um einen Knochenmarksdefekt handelt dürfen diese Menschen nicht mit DMARDs (disease-modifying antirheumatic drugs (https://flexikon.doccheck.com/de/Disease-modifying_anti-rheumatic_drug)) gegen Rheuma behandelt werden, weil diese knochenmarkstoxisch sind und das VEXAS Syndrom verstärken können.
Methylenetetrahydrofolate Reductase Gen Polymorphismus
“In Europa sind 8-20 % der Bevölkerung homozygot für die MTHFR-Variante (Methylentetrahydrofolat-Reduktase), die den Folatstoffwechsel beeinträchtigt und den Homocysteinspiegel erhöht. Erhöhte Homocysteinwerte gelten zwar als Risikofaktor für thromboembolische Ereignisse, doch die genaue klinische Bedeutung ist nach wie vor umstritten. Jüngste Forschungsergebnisse deuten jedoch darauf hin, dass erhöhte Homocysteinwerte den Verlauf und die Schwere einer COVID-19-Infektion vorhersagen können. Angesichts des Mangels an zuverlässigen Biomarkern, die das COVID-19-Thromboserisiko vorhersagen, und der Zugänglichkeit des MTHFR-Screenings haben wir für diese Studie zwei Hauptziele festgelegt: (1) die Bestimmung des Zusammenhangs zwischen erblichen MTHFR-Mutationen und dem Schweregrad der COVID-19-Infektion sowie thromboembolischen Ereignissen und (2) die Bestimmung des Zusammenhangs zwischen MTHFR-Varianten und unerwünschten thrombotischen Ereignissen nach einer COVID-19-Impfung.” (https://pubmed.ncbi.nlm.nih.gov/38138914/)
Mehr dazu bei Peter McCulough:
Antiphospholipid Syndrome
Zusammenspiel diverser Abwehrmechanismen?
Es gibt ein Review über die Thrombosemechanismen, die durch das SARS-COV2-Virus selbst ausgelöst werden können. In wieweit diese Mechanismen direkt auf das Spike-Protein oder die COVID-Spritzen selbst übertragbar sind, ist schwer zu sagen. Auch kann ich nicht sagen inwieweit sich diese Mechanismen wirklich bewahrheitet haben. Das Review versucht einen Überblick über das Zusammenspiel von Fibrin(Ogen), D-Dimer, Von-Willebrand-Faktor, P-Selektin und ihre Interaktionen mit Endothelzellen, Blutplättchen und Erythrozyten als recht komplexes Modell zu erklären (https://www.mdpi.com/1422-0067/21/14/5168). Ich finde die Schaubilder beeindruckend. Das Review stammt aber aus dem Juli 2020 als eher phänomenologische Beobachtungen der Infektion vorlagen. Inwieweit das auf die Covid-Spritzen und ihre Effekte übertragbar ist, kann ich nicht so wirklich beurteilen, ich füge die Schaubilder aber hier hinzu, weil sie einen Eindruck über das möglicherweise sich im Hintergrund abspielende komplexe Zusammenspiel der diversen Mechanismen geben. Fachlich bin ich aber bei derartigen Signalnetzwerken raus.
Aber der Zusammenhang zwischen Fibrin und D-Dimeren wird schön erklärt. Ja, wenn man Fibrin mit z. Bsp. Nattokinase verdaut, geht der D-Dimer Wert hoch, aber nicht wegen Herzproblemen, sondern weil Fibrin aus D-Dimeren besteht.
Pathologische Daten
Updates:
23.01.2024: Extrazelluläre DNA - ein Gefahrensignal, das Immunthrombose auslöst
25.03.2024: Das SARS-CoV-2S-Protein aktiviert das NLRP3 Inflammasom und dereguliert Gerinnungsfaktoren in Endothel- und Immunzellen + Zusammenspiel mehrerer Mechanismen
8.02.2024: Seok JK, Kim M, Kang HC, Cho YY, Lee HS, Lee JY. Beyond DNA sensing: expanding the role of cGAS/STING in immunity and diseases. Arch Pharm Res. 2023 Jun;46(6):500-534. doi: 10.1007/s12272-023-01452-3. Epub 2023 Jun 24. PMID: 37354378; PMCID: PMC10333371. https://pubmed.ncbi.nlm.nih.gov/37354378/. Danke hierfür an Christie.
15.02.2024 LNP-mRNA aktiviert das Inflammasom + Das Lipid selbst kann das Inflammasom auslösen.
21.02.2014 Hyperviscosity syndrome in COVID-19 and related vaccines: exploring of uncertainties - PubMed (nih.gov) + https://www.nature.com/articles/s41598-017-01148-x /
20.04.2024: cGAS-STING Aktivierung über ER-Stress https://pubmed.ncbi.nlm.nih.gov/38378748/
09.05.2024: SARS-CoV-2 and the spike protein in endotheliopathy - PubMed (nih.gov)
10.05.2024: Never-Before-Seen Abnormal Blood Clots in COVID-19 Vaccinated Patients (substack.com)
04.11.2024: Antiphospholipid Syndrome
























Abermals unendlichen Dank für die hervorragende Arbeit!
Hoffe, dass Du all Deine Ausarbeitungen zu diesem Themenkomplex in einem Werk veröffentlichen wirst.
Ein großes DANKE für all die Mühe! Conditio sine qua non. Wird immer schwieriger zu leugnen, auch wenn sich die Staaten in den Verträgen mit den Herstellern zum umfassenden Rechtsschutz der Hersteller verpflichtet haben.