Die EMA weiß, dass der DNase I - Verdau nicht funktioniert und hier sind die Dokumente, die das belegen
Wenn das Problem nicht behoben werden kann, ist die modRNA-Plattform tot
Diese Daten sind so brisant, dass ich sie einzeln auslager, weil sie in meinen Artikeln als Teilaspekt unterzugehen scheinen.
DIE EMA WEISS, DASS DER DNASE I -VERDAU NIE FUNKTIONIERT HAT UND IMMER NOCH NICHT FUNKTIONIERT UND HAT DAS AKZEPTIERT!!!!!!!!!!!!!!
Originalquellen der Daten sind zwei Twitter-Threads, die ich hiermit nur archiviere
https://twitter.com/a_nineties/status/1724660618265833786
https://twitter.com/a_nineties/status/1734324273022488712
Dokumentenquellen:
Assessment Report REC 027 2021
Type II group of variations assessment report 2022
https://mega.nz/file/GIolzLDZ#Y-2dlSbF4VfA28S1mjJm_CCcn7mtTlOiHUBUO5AYhaU
Type IB variation report 16.08.2021
https://mega.nz/file/eIoSyQyS#Y2g4VtSCUlDXg9JSTY32BQIM8_Up9I8xtrkg0SMxIFw
Type IB variation report 23.09.2022
https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1252-Type-IB-variation-report.pdf
Schwärzungen wurden von der EMA selbst vorgenommen.
Alle 4 Dokumente + Korrespondenz
Erläuterung/Übersetzung der Dokumente:
„Der MAH = marketing authorisation holder (BioNTech/Pfizer) soll Ergebnisse der Studien vorlegen, welche durchgeführt wurden, um die Stabilität des DNaseI Verdaus in der aktiven Substanz des Herstellungsprozesses zu erhöhen.“ (https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1251-Assessment-Report-for-the-Post-Authorization-Measure-REC-027.pdf Seite 4)
Das war im März 2021. Alle Chargen, die davor produziert wurden hatten wohl einen nicht sonderlich stabilen DNaseI Verdau.
Warum das wichtig ist, hier mal die biologischen Basics:
Plasmid DNA dient als Kopiervorlage für die modRNA.
DNA wäre ein Problem in den Produkten, weil sie bereits in nackter Form in Zellen eindringen und ins Genom integrieren kann (https://pubmed.ncbi.nlm.nih.gov/11251389/). Zudem würde es sich in diesem Fall um ein komplett anderes, selbst ebenfalls biologisch aktives Produkt als (Bei-)Produkt handeln. Statt nur modRNA, die angeblich nicht integriert und laut Moderna eine Halbwertszeit von 60h hat (https://www.judicialwatch.org/documents/jw-v-hhs-biodistribution-prod-4-02418/ S. 190), was BioNTech/Pfizer für ihr Produkt übrigens nie bestimmt haben, hätte man sehr stabile DNA, die dauerhaft ins Genom integriert. Beantragt wurde aber eine modRNA-Impfung und keine Plasmid-DNA-Impfung wie in Indien (https://www.europeanpharmaceuticalreview.com/news/160968/zycov-d-becomes-worlds-first-plasmid-dna-vaccine-for-covid-19/). Man würde also, bei nicht korrektem Entfernen der DNA-Kopiervorlagen zwei verschiedene Produkte gleichzeitig verabreichen: eine modRNA-Impfung und eine DNA-Impfung.
DNase I ist ein Protein/Enzym, das DNA verdaut/hackstückelt und so, theoretisch, entfernen sollte. Das funktioniert aber möglicherweise nicht, weil modifizierte Bausteine für die Herstellung der modRNA verwendet werden, die „klebriger“ sind als die natürlichen Bausteine und daher kann das Enzym DNase I die Kopiervorlage nicht verhackstückeln. Die detaillierte Herleitung, anhand der bekannten Literatur, warum das der Fall ist findet man hier:
Der entsprechende Teil wie BioNTech/Pfizer das Problem erklären ist in den EMA Dokumenten leider geschwärzt.
Es wurde kein detaillierter Bericht zu den begonnen Studien, um die Stabilität des DNase- Verdaus zu erhöhen, eingereicht.
[…]
Es wird erwartet, dass eine detaillierte Zusammenfassung der Ergebnisse der durchgeführten Studien zur Erhöhung der Stabilität des DNase-Verdaus in Modul 3.2.S.2.5 des Dossiers bis Ende des zweiten Quartal 2021 enthalten sein wird.
[…]
PAM (Post-authorization measure) = Maßnahme nach der Zulassung: NICHT ERFÜLLT.
Bis Mitte 2021 war also definitiv ein DNA belastetes Produkt auf dem Markt und das mit Wissen und Segen der EMA.
Daher waren die Produkte aus dem Hause BioNTech Pfizer zu dem Zeitpunkt NICHT GMP konform:
Man gab BioNTech/Pfizer Aufgaben auf:
Die Empfehlung Nr. 7, die Ergebnisse der Studien zur Verbesserung der Robustheit des DNase-Verdauungsschritts vorzulegen, wurde nur teilweise erfüllt. Es sind weitere Maßnahmen erforderlich, um die Empfehlung in Modul 2.3.5.2.5 des Dossiers bis zum Ende des zweiten Quartals 2021 zu erfüllen.
Antwort auf die Maßnahme nach der Zulassung
[...] Im Anschluss an den während der ACMF-PPQ-Kampagne beobachteten Anstieg der Rest-DNA wurden Versuche in kleinem Maßstab eingeleitet, um die Robustheit des DNase-I-Verdauungsschritts zu verbessern. Es wurden Studien durchgeführt, um die Auswirkungen von Reaktionskomponenten, Prozess- und Betriebsparametern auf die Höhe der Rest-DNA-Template besser zu verstehen. Die Studien im kleinen Maßstab sind nicht schlüssig und es werden keine Anpassungen des DNase-Schrittes empfohlen, daher werden die Daten aus diesen Studien nicht bereitgestellt.
[…]
Pfizer hat ein Aktivitätsassay für eingehende Enzyme eingeführt, um Ausreißer zu überwachen, die die Produktqualität von Arzneimitteln beeinträchtigen, bis Akzeptanzkriterien für den neuen Assay festgelegt werden können. Dies umfasst (ab hier geschwärzt).
Das Problem war aber am 29.03.2022 jedoch immer noch nicht behoben, wie man im Type 1B variation report (https://postvac.org/wp-content/uploads/wpforo/attachments/3025/1252-Type-IB-variation-report.pdf) auf Seite 16 nachlesen kann. Die Vorgaben aus dem Jahr 2021 waren Ende März nur teilweise erfüllt. 1 Jahr ist also bei diesem Punkt bereits anhand der EMA Aktenlage nachweisbar, dass dieses immer noch DNA kontaminiert ist.
20/05/2021: Weitere Maßnahmen sind erforderlich, um die Empfehlung 7 zu erfüllen, einschließlich der Vorlage einer detaillierten Zusammenfassung der Ergebnisse [...]
Var IB-55: Es werden keine Ergebnisse vorgelegt, da der Antragsteller die Studie in kleinem Maßstab für nicht schlüssig hält und keine Anpassung des DNase-Digestionsschritts empfohlen wird.
Im Klartext: Hat nicht geklappt mit dem stabileren DNase I - Verdau, Änderung würde nichts bringen, wir machen weiter wie bisher.
Die EMA hat das akzeptiert und die Akte am 29.03.2022 wohl einfach geschlossen, weil sie den Firmen nicht beikam und diese einfach nicht geliefert haben. An dieser Stelle hätte man das Produkt jedoch vom Markt nehmen müssen, weil der Herstellungsprozess nicht GMP konform war und ist.
Darüber gibt es von Seiten des PEI nichts mehr zu diskutieren. DAS STEHT SO IN DEN EMA DATEN!
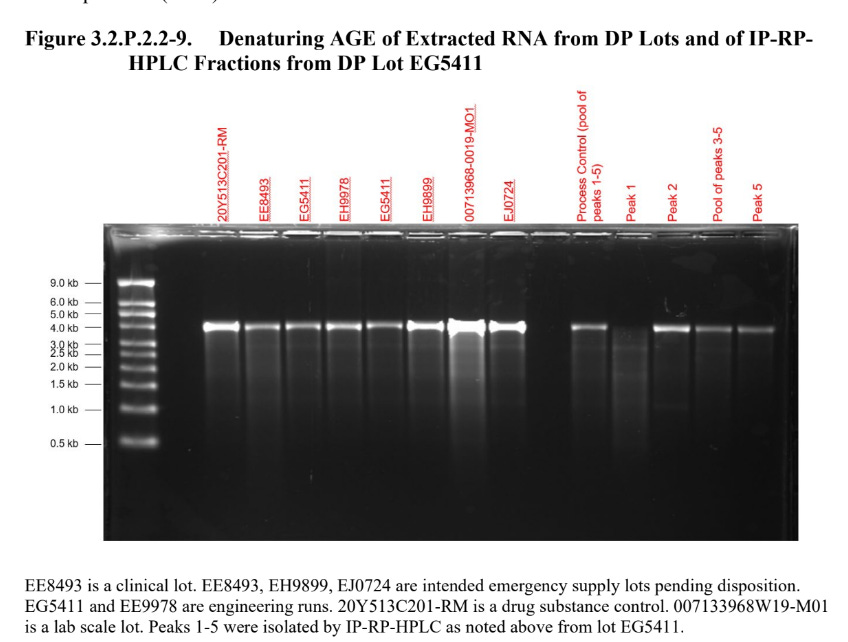
Und wenn man genau hinschaut, auch in den Pfizer Daten: Was genau waren wohl die Fragmente vor dem Peak und die Fragmente nach dem Peak? Sauber ist anders.
(Annex 1 - Draft 3.2.P.2.2 Drug Product.pdf - Google Drive S. 32)
Ganz abgesehen davon, dass ich im Labor bei so einer schmierigen Bande auf Seite 34, diese noch einmal aus dem Gel hätte ausschneiden und reinigen müssen. Da sollte eine Bande sein, nichts als eine saubere Bande und kein Schmier bis weiter unterhalb von 0,5 kb.










You can't sell the wrong coloured olives in Europe without being busted, yet it's quite ok to inject adulterated toxic garbage into millions without a word.
More Mislabeled Oil and Dangerous Colored Olives Seized in Italian Raids
https://www.oliveoiltimes.com/business/europe/more-mislabeled-oil-and-dangerous-colored-olives-seized-in-italian-raids/50481
Certainly both Pfizer, Biotech and Moderna should go broke over this fraud. But as usual, the bigpharma will stay and all the people who got poisoned get nothing. Only a handful here in the US have been given a few hundred dollars. Some Aziatic countries have handed out some as well. I don't know if anyone in Europe has been compensated for deaths or injuries from the jabs.