Mögliche Autoimmunmechanismen durch COVID-modRNA-Produkte
Ein weiterer zugrundeliegender Grundschadmechamismus
Prävalenz von Autoimmunerkrankungen gestiegen
Es gibt grob drei Möglichkeiten, wie die modRNA-Produkte Autoimmunangriffe auf ein Organ auslösen können. Es kann sein, dass ich mit der Zeit weitere Mechanismen finde und ergänze, aber grob sind es zum Start erst einmal 3, weil Deadline und musste halt geschrieben werden.
Vorab:
ModRNA Produkte verteilen sich über diverse Mechanismen im ganzen Körper
1. Über die Lymphe
2. Über das Blut
3. Über in der Leber gebildete Exosomen analog zu Onpattro (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7187331/) mit einer Halbwertzeit von 60-80 Tagen (https://pubmed.ncbi.nlm.nih.gov/31777097/) auf dessen Pharmakokinetik sich BioNTech/Pfizer in den Zulassungsunterlagen beziehen (https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf).
Genauer steht es hier:
Mögliche biochemische Wege zu shedden
Eigentlich sind die Puzzlestücke schon alle irgendwo in meinen Artikeln, aber ich fasse sieh hier einmal in einem gemeinsamen Artikel zusammen und strukturiere sie um. Text- und Buchstabenrecycling, um die Umwelt zu schonen. Wer weiß, vielleicht werden in Deutschland irgendwann sogar dich Buchstaben knapp. Darf ich das „Z“ mittlerweile wieder verwenden …
Langfristig wird dadurch jedes Organ des Körpers binnen eines Jahres transfiziert, so dass Symptome sich auch Monate nach der Impfung entwickeln können.
Mechanismen
Präsentation von Spike-Fragmenten über MHCI
Das Organ wurde durch das modRNA-Produkt transfiziert. Teile des daraufhin produzierten Spike-Proteins werden zur Qualitätskontrolle auf MHCI dem Immunsystem präsentiert, welches einen Autoimmunangriff auf Spike-Protein produzierende Zellen auslöst.
Das Schulbuch Linder Biologie Gesamtausgabe 23. Auflage zeigt das auf Seite 238 als Übersichtsbild.
Mittlerweile gibt es auch Belege, dass dies geschieht und welche Peptide präsentiert werden (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8383889/).
Molekulare Mimikry
Das Spike-Protein hat sehr viele Regionen, die Ähnlichkeiten zu menschlichen Proteinen aufweisen. Da nennt man molekulares Mimikry. Somit könnten Antikörper die eigentlich gegen das Spike-Protein gerichtet sein sollten stattdessen körpereigene attackieren und zerstören (https://pubmed.ncbi.nlm.nih.gov/33584709/).
(https://pubmed.ncbi.nlm.nih.gov/32292901/):
Die Vermutungen der zu humanen Proteinstrukturen ähnlichen Anteile des Spike Proteins gehen in einer Studie in den Bereich von mehr als zwei Dutzend Hepta- und Oktamere (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8387358/) zu 78.4% bei Fragmenten von 5-6 Aminosäuren (https://pubmed.ncbi.nlm.nih.gov/34192262/).
Die Hinweise auf molekulare Mimikry, welche bekannt dafür ist, zu Autoimmunangriffen zu führen (https://pubmed.ncbi.nlm.nih.gov/30509385/), verdichten sich immer mehr (https://doi.org/10.1101/2024.02.15.24302857, https://pubmed.ncbi.nlm.nih.gov/33584709/, https://www.mdpi.com/1999-4915/14/7/1415)
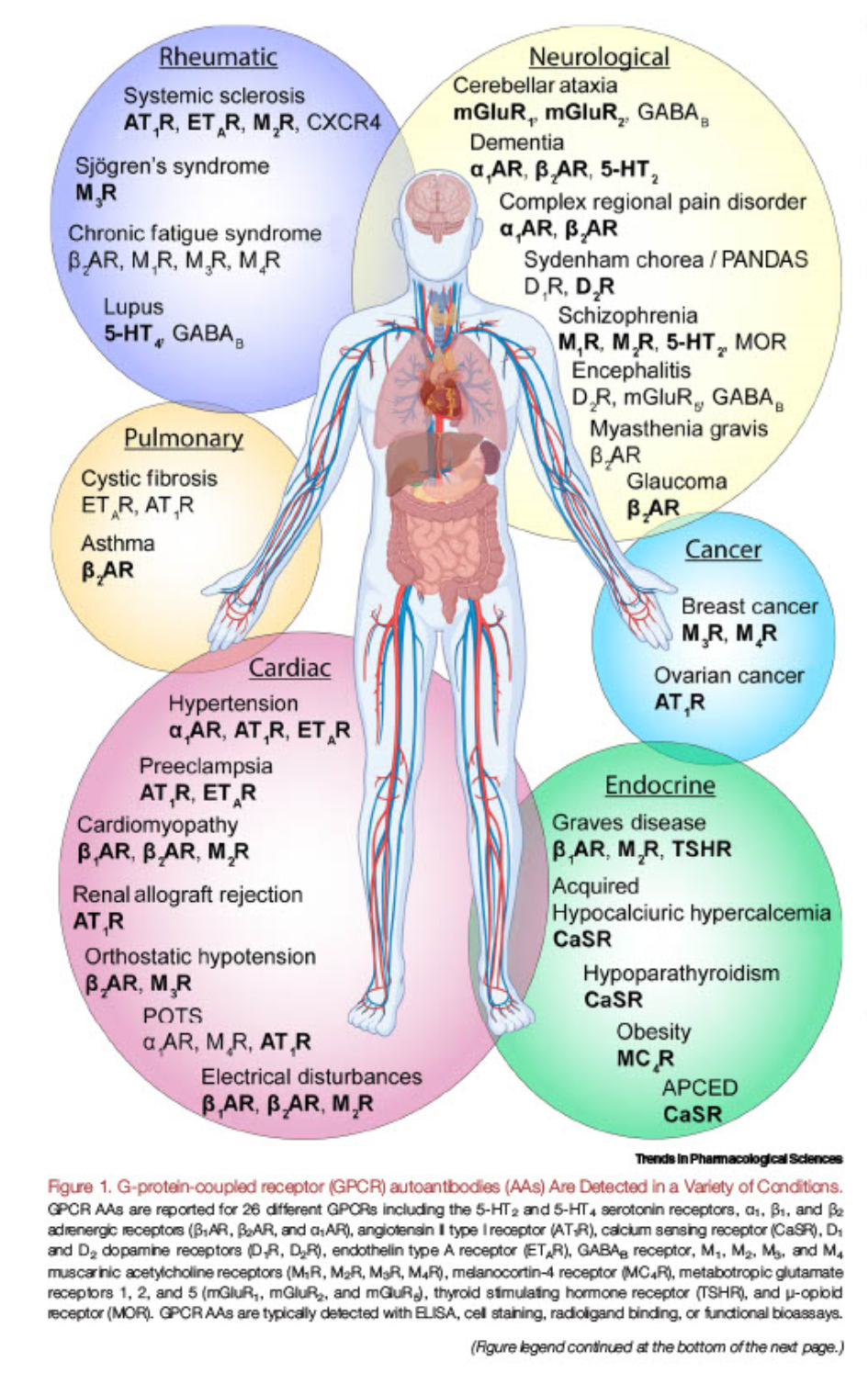
Einer der herausragenden Autoantikörper in diesem Zusammenhang, der sich bilden kann, ist die GPCR-Ak (Ak steht für Antikörper). G steht für G-Protein gekoppelte Rezeptoren. Diese G-Protein gekoppelte Rezeptoren sind eine große Familie mit sehr viele Mitgliedern, die für die Signalübertragung in unseren Zellen verantwortlich sind. (https://flexikon.doccheck.com/de/G-Protein-gekoppelter_Rezeptor). Wird die Signalübertragung durch GPCR-Antikörper gestört, führt das unter anderem zu CFS, neben vielen weiteren Beschwerden https://pubmed.ncbi.nlm.nih.gov/33358695/),
wie die Abbildung aus der genannten Publikation eindrucksvoll zeigt. Man braucht die Details nicht zu verstehen, um intuitiv zu sehen, dass GPCR-Ak alles anderes als gesund sind und unter anderem zu Chronic Fatigue Syndrom (CFS) führen. Und das ist nur ein möglicher Autoantikörper.
Das Problem ist mittlerweile auch bestätigt:
“In dieser Gruppe zeigten die serologischen Tests, dass zusätzlich zur Positivität für Anti-Spike-Protein-Antikörper ein hoher Prozentsatz der Probanden positiv für Antikörper gegen G-Protein-gekoppelte Rezeptoren und Moleküle war, die an der Reaktion auf SARS-CoV-2 beteiligt sind. In einem Panel von 16 getesteten Autoantikörpern wurden einige positiv mit einigen der von den Patienten berichteten Symptome in Verbindung gebracht: Anti-ATR1 mit Lymphadenopathie und/oder Tonsillitis; Anti-ACE2 mit Hautsymptomen wie Ekchymosen, Hautödemen und Hautausschlag; Anti-MAS1 mit weitverbreitetem Brennen; und Anti-STAB1 mit Hautödemen und Hautausschlag. Anti-ADRA2A stand in negativem Zusammenhang mit Gedächtnisverlust und/oder geistiger Umnachtung. ACE2 korrelierte mit den Serumspiegeln von Anti-S-Antikörpern, was die Hypothese eines Anti-Idiotyp-Mechanismus in der Immunpathogenese von PACVS unterstützt. Schlussfolgerungen: Diese explorative Analyse deutet darauf hin, dass der Gehalt an Autoantikörpern, die gegen ACE2 und wahrscheinlich auch gegen MAS1 und STAB1 gerichtet sind, als Biomarker für PACVS dienen können.”
Unvorhersagbare Antikörper aufgrund von Spike Multimeren
Das Spike-Protein wird auch als freies Spike Protein ins Blut freigesetzt (https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.061025). Das Spike Protein bildet jedoch nicht nur Trimere (drei Untereinheiten gehen zusammen, die ein Spike-Protein bilden), wie auf der Oberfläche des Virus. Freies Spike kann auch Hexamere und Nonamere bilden, also Zusammenballungen von zwei Trimeren oder drei Trimeren.
(https://www.science.org/doi/10.1126/science.abe1502).
Gegen diese Hexamere und Nonamere werden sich anderen Antikörper bilden als gegen das natürliche Trimer des Virus. Erschwerend kommen hybride Trimere hinzu durch Kreuzimpfungen und Boosterimpfungen, also Trimere, die sich aus den Proteinen verschiedener Impfprodukte und aktualisierten Impfstoffen zusammensetzen. Die Rezeptoren der B- und T-Zellen, sowie Antikörper sind flexibel und können sich auch verbiegen. Dadurch können Antikörper entstehen, die unkontrollierbar und unvorhersehbar zufällig an Körperstrukturen (fehl-)binden und so Autoimmunangriffe über Kreuzreaktionen provozieren, indem sie körpereigene Zell(strukturen) mit Antikörpern markieren, die anschließend zerstört werden.
Im schlechtesten Fall entstehen Antikörper auf eine Kombination aus molekularer Mimikry und hybrider Multimerstruktur. Dann wird es spannend und extrem unvorhersagbar.
Autoimmunität durch ER-Stress und damit freigesetzte mtDNA
Professor Gunther Hartmann von der Uni Bonn (der aktuelle Gerichtsgutachter FÜR BioNTech) zeigt in einer seiner aktuelle Studie aus dem Februar 2024 mit dem Namen „Chronischer Stress des endoplasmatischen Retikulums bei myotoner Dystrophie Typ 2 fördert Autoimmunität durch Freisetzung mitochondrialer DNA“ (https://pubmed.ncbi.nlm.nih.gov/38378748/), dass Muskeln durch einen Autoimmunangriff zerstört werden, wenn das Endoplasmatische Retikulum gestresst wird und dadurch mitochondriale RNA (mtRNA) freigesetzt wird.
Myotone Dystrophie „ist eine hereditäre Muskelerkrankung, die unter anderem mit Muskelsteifheit und Muskelschwäche einhergeht.“ (https://flexikon.doccheck.com/de/Myotone_Dystrophie)
In der Publikation in welcher Professor Hartmann Mitautor ist, wird im Abstract folgendes Fazit gezogen:
EN: „Altogether, our study demonstrates a novel mechanism by which large repeat expansions cause chronic endoplasmic reticulum stress and associated mtDNA leakage. This mtDNA is, in turn, sensed by the cGAS/STING pathway and induces a type-I IFN response predisposing to autoimmunity. Elucidating this pathway reveals new potential therapeutic targets for autoimmune disorders associated with repeat expansion diseases.“
DE: „Insgesamt zeigt unsere Studie einen neuen Mechanismus, durch den große Wiederholungsexpansionen chronischen endoplasmatischen Retikulumstress und damit verbundenen mtDNA-Austritt verursachen. Diese mtDNA wird wiederum durch den cGAS/STING-Signalweg erkannt und löst eine Typ-I-IFN-Reaktion aus, die zu Autoimmunität führt. Die Aufklärung dieses Weges eröffnet neue potenzielle therapeutische Ansatzpunkte für Autoimmunerkrankungen, die mit der Wiederholungsexpansion in Zusammenhang stehen.“
Etwas detaillierter:
„Chronischer ER-Stress führt zu ATF6-abhängiger mitochondrialer DNA-Freisetzung, ROS-Produktion und einer cGAS-STING-abhängigen Hochregulierung von Typ I IFN und ISGs.“
Nun ist es jedoch so.
1. Das Spike-Protein wird laut BioNTech eigenen Unterlagen im Endoplasmatischen Retikulum produziert (ER) (https://www.tga.gov.au/sites/default/files/foi-2389-03-1.pdf und tga.gov.au/sites/default/files/foi-2389-06.pdf)
2. Es konnte mittels Raman-Spektroskopie auf zellulärer Ebene gezeigt werden, dass das ER nach der modRNA-Impfung Schaden nimmt (https://www.biorxiv.org/content/10.1101/2022.03.02.482639v1.full.pdf). Dieses Ergebnis verwirrte die Autoren der Studie, da diese fest davon ausgingen, dass das Spike-Protein im Zytosol produziert wird, was falsch ist. Umso zuverlässiger ist deren somit kontraintuitive Messung, die der Hypothese der Autoren widerspricht. Mit dem Wissen, dass das Spike-Protein im ER produziert wird, ist die Messung schlüssig.
3. Der durch den Stress durch permanente Spike-Produktion in hoher Konzentration im ER verursachte Austritt von mtRNA führt zu einer Autoimmunreaktion in Muskelzellen, wie Prof. Hartmann selbst belegt. Diesmal nicht wegen eines genetischen Defekts, sondern wegen eines erworbenen ER-Stresses, der sich über Jahre hinziehen kann, da die Spike-Produktion bei vielen Menschen mit Muskelabbau immer noch aktiv ist und nicht stoppt.
4. Dieser Autoimmunangriff kann somit theoretisch in jedem Zelltyp passieren, der unter dauerhaftem ER-Stress leidet. Es handelt sich hiermit um einen weiteren Mechanismus für Autoimmunität.
Autoimmunität bei IgG Produktion in Abwesenheit von IgM Antikörpern
Bei Systemischer Lupus erythematodes (SLE) gibt es Hinweise, dass IgG Antikörper an der Autoimmunreaktion beteiligt sein könnten, wenn die passenden IgM Antikörper fehlen. Zudem “führte das Fehlen von sezerniertem IgM zu einer beschleunigten Entwicklung von IgG-Autoantikörpern in normalen Mäusen. Diese Ergebnisse deuten darauf hin, dass sekretiertes IgM, einschließlich IgM-Autoantikörper, die auf natürliche Weise oder als Teil einer Autoimmunreaktion gebildet werden, die Schwere der mit IgG-Autoantikörpern verbundenen Autoimmunpathologie verringern können.” (https://pubmed.ncbi.nlm.nih.gov/10655505/)
Der Wechsel der Ig-Klasse zu IgG4 (https://pubmed.ncbi.nlm.nih.gov/36548397/) findet meist nach der Booster mit modRNA statt nicht nach Protein-Impfstoffen wie Novavax. Und von denen stammt diese Publikation auch und ist daher mit einer gewissen Vorsicht zu genießen (https://www.medrxiv.org/content/10.1101/2024.01.17.24301374v1). In diesem Paper findet sich aber noch ein sehr spannender Satz: “Wiederholte NVX-CoV2373-Impfung verstärkt die IgG3-Antwort auf einzigartige Weise”. Das deutet darauf hin, dass auch Novavax zu Autoimmunreaktionen über IgG führen könnte. Dieser Satz hätte den Autoren eigentlich Sorgen bereiten müssen.
Auch Adenovirenprodukte scheinen bei IgG4 nicht so das Problem zu sein (https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2022.1020844/full), aber auch diese Produkte induzieren eine IgG Antwort und keine IgM Antwort, folglich haben sie somit ein Risiko Autoimmunreaktionen zu erzeugen.
Anti-ACE2 Antikörper
“Humane Angiotensin-Converting Enzyme 2 (ACE2) kreuzreaktive Anti-SARS-Coronavirus-2-Spike-Protein-Rezeptor-bindende Domäne (SARS-CoV-2 RBD) Antikörper (CR Abs) wurden als eine der Quellen von Anti-ACE2-Autoantikörpern berichtet.“ (https://pubmed.ncbi.nlm.nih.gov/38637878/)
Ein möglicher Schadmechanismus über ACE2 wäre also ein Autoimmunangriff auf Zellen, an deren ACE2-Rezeptoren anti-ACE2-Antikörper gebunden haben und somit die Zelle für den Abschuss durch das Immunsystem markiert haben.
Mastzellaktivierungssyndrom
Auch ein MCAS kann zu Autoimmunreaktionen führen (https://pubmed.ncbi.nlm.nih.gov/32324159/)
Mastzell-Aktivierungssyndrom (MCAS Mast Cell activation Syndrome)
Disclaimer und Spoiler: Es mag nach diesem Artikel vielleicht so klingen, dass die MCAS die Ursache für alle Nebenwirkungen sein könnte. ABER VORSICHT! Der Körper hat N Möglichkeiten sich zu äußern. Diesen Symptomen können aber X verschiedene Ursachen zugrunde liegen.
Mastzellen können durch das Komplement aktiviert werden:
Das Spike-Protein aktiviert den alternativen Weg des Komplementsystems
Ich glaube, wir müssen dringend über das Komplementsystem reden.
Antikörper gegen +1 ribosomal frameshift Proteine
Bei BNT162b2 inokulierte Menschen wurde eine signifikant höhere Interferon-(IFNγ)-Reaktion auf +1 frameshiftete Proteine/Antigen festgestellt (https://pubmed.ncbi.nlm.nih.gov/38057663/, https://bpspubs.onlinelibrary.wiley.com/doi/10.1002/prp2.1218#prp21218-bib-0050). Immunreaktionen auf +1 framgeeshiftete Produkte wurden nur bei mit BNT162b2 geimpften Personen beobachtet, nicht bei Menschen, die mit Adenoviren oder direkt mit Spike-Protein inokuliert wurden. Man kann also Antikörper auf aktuell noch unbekannte Proteine und deren fehlgefaltete Varianten bilden, die auch mit den eigenen körpereigenen Strukturen kreuzreagieren könnten.
Reicht CGas/STING alleine?
Knabl, Ludwig, Hye Kyung Lee, Mary Walter, Priscilla A. Furth, and Lothar Hennighausen (2022). Immune transcriptome and antibody response in adult-onset Still’s disease with mild flare following administration of mRNA vaccine BNT162b2.“ Rheumatology 61(10): e305-e307.
Makrophagenpolarisation
Andere Substacks zum Thema
Updates:
19.04.2024: Autoimmunität durch ER-Stress und damit freigesetzte mtRNA.
22.04.2024: Autoimmunität bei IgG Produktion in Abwesenheit von IgM Antikörpern / Anti-ACE2 Antikörper
09.05.2024: GPCR-Ak
13.06.2024: Diagnosis of mast cell activation syndrome: a global "consensus-2" - PubMed (nih.gov)
17.06.2024 Antikörper gegen +1 ribosomal frameshift Proteine
04.04.2025:
21.05.2025:
















not sure if I would call it exiting!
Sie sind immer ein Genuss zum lesen. Gott segne Sie für die tolle Arbeit.