EU will saRNA Kostaive zulassen Teil 3
Die japanischen Zulassungsdokumente Seite 19-33 (von 68)
Teil 1 der Erklärungen zum japanischen Zulassungsdokument
Teil 2 der Erklärungen zum japanischen Zulassungsdokument
Hier geht es nun um die Studien am Menschen.
Ich befinde mich auf sehr dünnem Eis.
Ich habe keine Ahnung von Studien und Studiendesign.
Ich kann nur sehr oberflächlich schauen, was mir als Laie auf dem Gebiet klinischer Studien, auffällt.
Das muss sich eigentlich jemand mit Ahnung von so etwas anschauen. Hat nur bisher leider keiner gemacht.
Übersicht über die Studien:
Folgende Studien am Menschen wurden durchgeführt.
Was bei den Studienzentren direkt auffällt: Fast nur Asiaten.
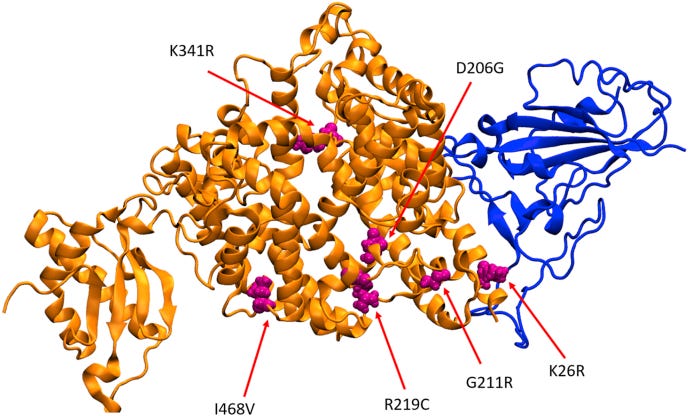
Der ACE2 Rezeptor variiert unter den Ethnien.
Diverse Substanzen wirken in unterschiedlichen Ethnien unterschiedlich.
Gibt es überhaupt Studien an Europäern?
Kostaive wurde zwar in Phase I/II in USA an 12 Menschen getestet, also von den 12 waren möglicherweise auch Amerikaner dabei, die möglicherweise asiatischer Herkunft waren…
Kann man ein Produkt auf dem europäischen Markt zulassen, dass man gar nicht in Langnasen getestet hat?
Ein weiteres Problem: Erneut wurde nur IgG gemessen und kein IgA. ABER, das Produkt soll ja nur vor COVID-19 schützen, also vor einem schweren Verlauf und nicht vor Ansteckung. Da ist das wohl OK, schätze ich.
ARCT-021-04
Zielstichprobengröße: 600 Probanden [300 im Alter von 18 bis 55 Jahren, 300 im Alter von ≥56 Jahren; jeweils 150 in den Gruppen A, B, C oder D] an 15 Studienorten in den USA und Singapur.
Die Probanden wurden nach Alter (18-55, ≥56) geschichtet und randomisiert.
Das Dosierungsschema in jeder Gruppe war wie folgt:
Gruppe A: Eine Einzeldosis ARCT-021 7,5 µg, gefolgt von der Verabreichung eines Placebos (physiologische Kochsalzlösung) nach 28 Tagen.
Gruppe B: 2 Dosen ARCT-021 5 µg im Abstand von 28 Tagen.
Gruppe C: 2 Dosen ARCT-021 7,5 µg im Abstand von 28 Tagen.
Gruppe D: 2 Dosen Placebo im Abstand von 28 Tagen.
Positiv: Das Placebo war Kochsalzlösung
Von 143 Probanden, die EINE Dosis 7,5µg erhielten, entwickelten ca. 7% einen vierfach erhöhten Antikörpertiter zur Baseline
Von 145 Probanden, die ZWEI Dosen 5µg erhielten, entwickelten ca. ca. 34% einen vierfach erhöhten Antikörpertiter zur Baseline
Von 144 Probanden, die ZWEI Dosen 7,5µg erhielten, entwickelten ca. 35% einen vierfach erhöhten Antikörpertiter zur Baseline
Ob man zwei Dosen 5µg oder 7,5µg bekommt, macht kaum einen Unterschied, es kommt auf die zwei Dosen an.
ABER
selbst nach zwei Dosen bilden “nur” 1/3 überhaupt einen vierfach erhöhten Antikörpertiter zur Baseline.
Man sieht zudem, dass bei Gruppe A, die als zweite Spritze Kochsalz bekam bei 6 von 10 der Titer bereits wieder massiv gesunken war.
Der Effekt ist alles andere als langanhalten. Was man positiv sehen kann, das deutet darauf hin, dass nicht allzu lange Spike produziert wird.
ABER, wenn der “Schutz” bereits so schnell schwindet, wozu der Aufwand?
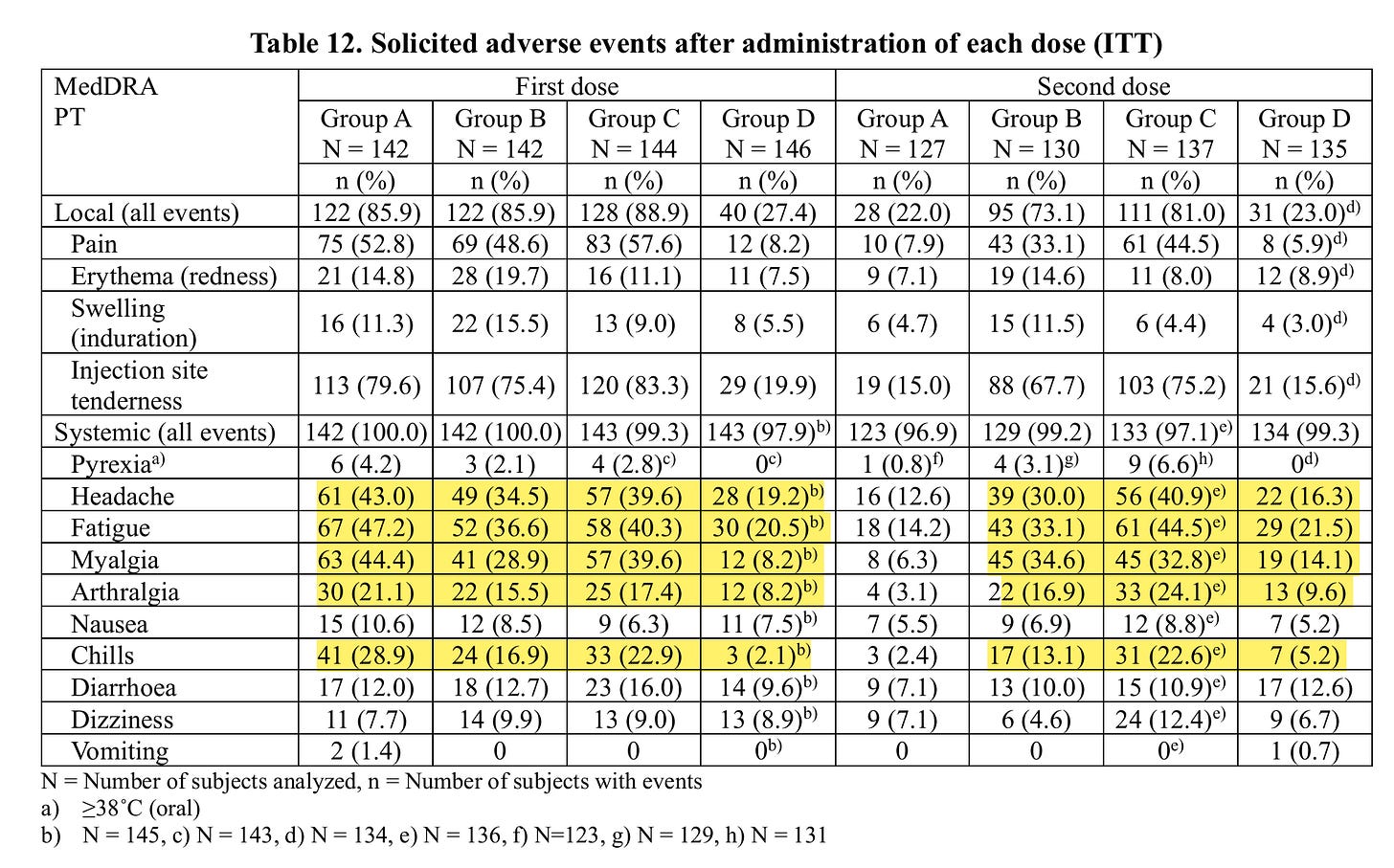
Die Nebenwirkungen bis 7 Tage nach der Spritze für diesen minimalen, kurzfristigen Effekt findet man in dieser Tabelle:
D ist Placebo!
Pyrexia = Fieber
Myaligie = Muskelschmerzen
Athralgie = Gelenkschmerzen
Alle Systemischen Nebenwirkungen waren bei A-C, die beim ersten mal Verum bekamen deutlich erhöht.
Bei der zweiten Dosis bekamen A und D Placebo und B und C Verum
Erstaunlich ist, dass bei A die Nebenwirkungen geringer sind als in der reinen Placebogruppe, vielleicht weil man nach den Nebenwirkungen beim ersten mal so erleichtert war, dass diesmal im Vergleich nichts zu merken war, dass man da mit kleinen Wehwehchen entspannter umging.
Die Nebenwirkungen bis 28 Tage nach der Spritze:
Schaut insgesamt unauffällig aus.
Es gab auch keinen Todesfall
ARCT-154-01
Inwieweit eine Studie rein an Asiaten auf Europäer übertragbar ist, sei einmal dahingestellt.
Es wurde eine randomisierte, beobachterblinde, placebokontrollierte Parallelgruppenstudie durchgeführt, um die Sicherheit und Immunogenität von Kostaive zu untersuchen.
Zielstichprobengröße bei gesunden Erwachsenen im Alter von ≥18 Jahren:
100 Probanden in Teil 1
300 Probanden in Teil 2
600 Probanden in Teil 3a;
Kostaive-Gruppe und Placebogruppe im Verhältnis 3:1 in jedem Teil) an 16 Studienorten in Vietnam.
In Teil 1
wurden die Probanden im Verhältnis 3:1 nach dem Zufallsprinzip der
Kostaive-Gruppe (5 µg) oder
der Placebogruppe (physiologische Kochsalzlösung) zugeteilt
und erhielten den Studienimpfstoff zweimal intramuskulär im Abstand von 28 Tagen.
2 Monate nach der zweiten Dosis (Tag 92) erhielten sie zweimal intramuskulär im Abstand von 28 Tagen Kostaive (Placebogruppe) oder Placebo (Kostaive-Gruppe).
ALSO Entweder
2x Kochsalz + 2x 5 µg saRNA
ODER
2x 5 µg saRNA + 2x Kochsalz
Insgesamt als 2x 5 µg saRNA, die Probanden wussten nur nicht, wann sie es bekommen.
In Teil 2 und Teil 3a
wurden die Probanden im Verhältnis 3:1 randomisiert der
Kostaive-5-µg-Gruppe oder
der Placebogruppe zugeteilt
und erhielten den Studienimpfstoff zweimal im Abstand von 28 Tagen intramuskulär.
2 Monate nach der zweiten Dosis (Tag 92) erhielten die Probanden eine der folgenden Behandlungen:
(1) Probanden, die bei der ersten Zuteilung Kostaive erhielten, wurden im Verhältnis 3:1 in die
Kostaive-5-µg-Gruppe oder
die Placebogruppe randomisiert
und erhielten eine Einzeldosis des Studienimpfstoffs, gefolgt von einer intramuskulären Verabreichung von Placebo nach 28 Tagen
(2) Probanden, die bei der ersten Zuteilung das Placebo erhielten, erhielten zweimal Kostaive 5 µg im Abstand von 28 Tagen.
Ich verstehe das so
2x 5 µg saRNA + 1x 5 µg saRNA + 1x Kochsalz
2x 5 µg saRNA + 2x Kochsalz
2x Kochsalz + 2x 5 µg saRNA
Wo genau ist nun die reine Placebogruppe?
Hätte man lieber zeichnen sollen. Die Beschreibung finde ich schwer verständlich.
Es schaut so aus, als wären Antikörper gebildet worden:
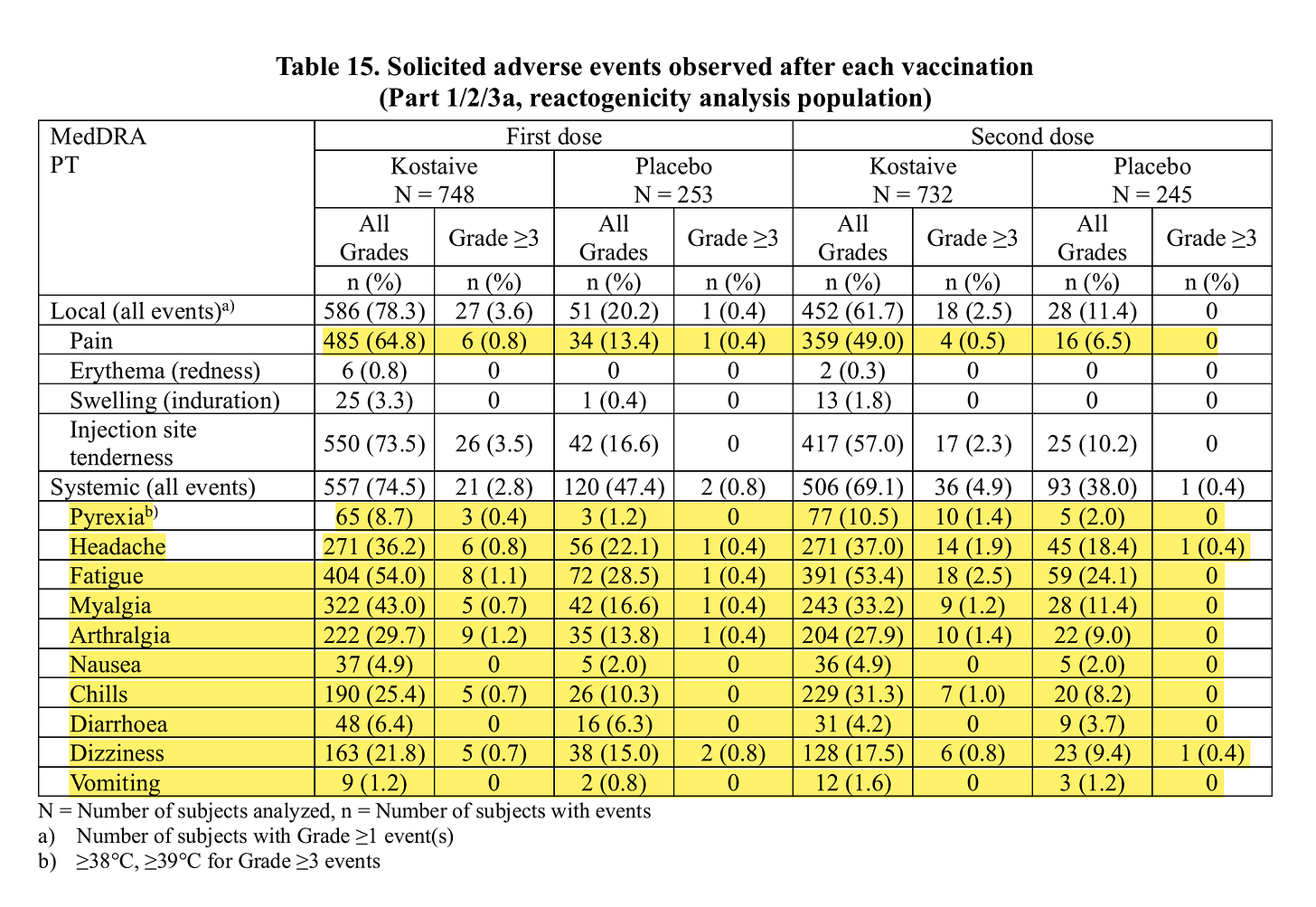
Nebenwirkungen nach bis zu 7 Tagen, sieht bei Verum im Vergleich zu Placebo bei allen Nebenwirkungen richtig bescheiden aus:
Nebenwirkungen nach bis zu 28 Tagen
Auch nach fast einem Monat geht es den “Behandelten” deutlich schlechter als der Placebogruppe.
Man scheint sich nach der Spritze auch einfacher eine Influenza einzufangen und einen Husten. Der “Schutz” scheint einem die Wahrscheinlichkeit für mindestens zwei Krankheiten zu erhöhen. Aber wer bin ich schon, ich habe keinen Maser in Clinical Studies, ich schaue mir nur die Tabellen an und versuche sie zu verstehen.
Statt Corona scheint man die Influenza zu bekommen?
Verstehe ich das richtig?
Unerwünschte Ereignisse, die zum Abbruch der Studie führten, wurden bei keinem der Probanden in der Kostaive-Gruppe und bei zwei Probanden in der Placebogruppe beobachtet (0,8 %, Vorhofflimmern und Urtikaria bei jeweils einem Probanden).
Bei keinem der Probanden in der Placebogruppe konnte ein kausaler Zusammenhang mit dem Studienimpfstoff ausgeschlossen werden.
Wie kann bei Placebo kein kausaler Zusammenhang mit dem Studienimpfstoff ausgeschlossen werden? Der Satz verwirrt mich. Ich habe das Studiendesign aber auch nicht so richtig verstanden.
Es gab keine Todesfälle.
Teil 3b der Studie ARCT-154-01
Es wurde eine randomisierte, beobachterblinde, placebokontrollierte Parallelgruppenstudie durchgeführt, um die Wirksamkeit und Sicherheit von Kostaive bei gesunden Erwachsenen im Alter von ≥18 Jahren (Zielstichprobengröße: 16.000 Probanden [8.000 in der Kostaive-Gruppe, 8.000 in der Placebogruppe] an 16 Studienorten in Vietnam zu untersuchen.
Die Probanden wurden im Verhältnis 1:1 randomisiert der
Kostaive-Gruppe mit 5 µg oder
der Placebogruppe (physiologische Kochsalzlösung) zugeteilt
und erhielten den Studienimpfstoff zweimal intramuskulär im Abstand von 28 Tagen.
2 Monate nach der zweiten Dosis (Tag 92) erhielten die Probanden der
Kostaive-Gruppe ein Placebo und die
Probanden der Placebogruppe erhielten zweimal intramuskulär im Abstand von 28 Tagen Kostaive.
ALSO Entweder
2x Kochsalz + 2x 5 µg saRNA
ODER
2x 5 µg saRNA + 2x Kochsalz
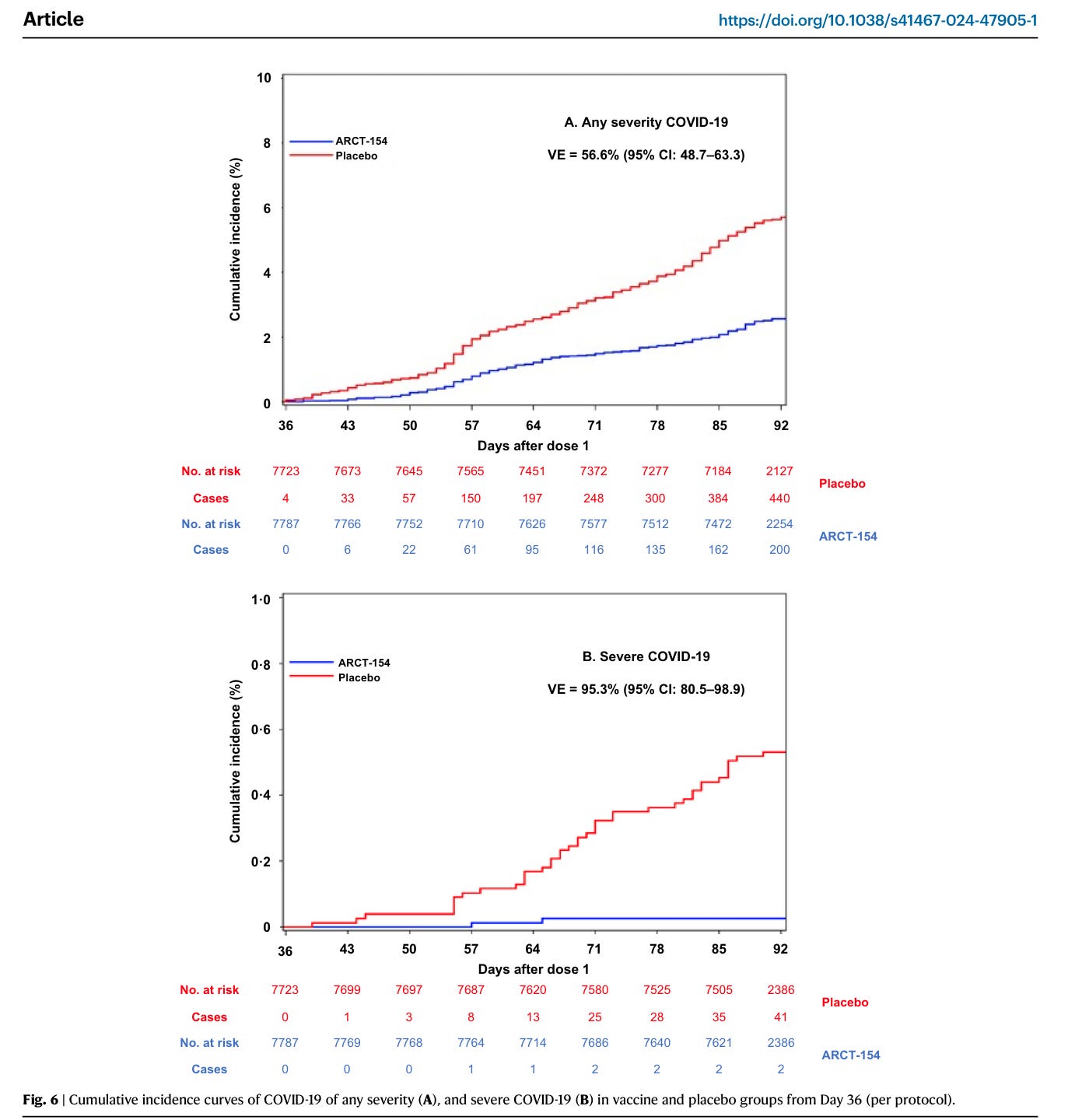
Von den Probanden in der ITT wurden Probanden, die den Studienimpfstoff zweimal gemäß dem Studienprotokoll erhalten hatten und bei denen von der ersten Dosis bis zu 7 Tagen nach der zweiten Dosis keine SARS-CoV-2-Infektion in der Anamnese vorlag (7.787 in der Kostaive-Gruppe, 7.723 in der Placebogruppe), in die ITT aufgenommen und als primäre Population für die Wirksamkeitsanalyse verwendet.
Ähm, sollte man das nicht als Nebenwirkung aufnehmen und nicht die Probanden aussortieren?
Der primäre Endpunkt war die Impfstoffwirksamkeit (VE) (VE = 1 – „Hazard ratio of the Kostaive group to the placebo group“), basierend auf den Fällen von bestätigtem COVID-19 (Auftreten von 7 Tagen bis 2 Monaten nach Ende der zweiten Dosis).
Was war als COVID Definiert?
Bestätigte COVID-19-Fälle wurden als Probanden definiert, die die folgenden 2 Kriterien gemäß der Richtlinie der Food and Drug Administration (FDA) zur Entwicklung von Impfstoffen zur Vorbeugung von COVID 1934 erfüllten:
• Probanden, die durch einen Nukleinsäure-Amplifikationstest eines Nasentupfers SARS-CoV-2-positiv waren
• Auftreten oder Verschlimmerung mindestens eines der folgenden Symptome: Fieber oder Schüttelfrost, Husten, Kurzatmigkeit oder Atemnot, Unwohlsein, Myalgie oder körperliche Schmerzen, Kopfschmerzen, neuer Verlust des Geschmacks- oder Geruchssinns, Schüttelfrost, Halsschmerzen, verstopfte oder laufende Nase, Übelkeit oder Erbrechen und Durchfall
Irgendwie scheinen mir die Nebenwirkungen des Produkte denen der Krankheit schon sehr ähnlich zu sein?!
Den Unterschied zwischen COVID und NEBENWIRKUNG macht ein PCR-Test mit hoher falsch-positiven Rate?
Was ist denn das für eine Studie?
440 Placebokandidaten hatten COVID und 200 Verumkandidaten.
Man hat COVID also auch mit Wundermittelchen bekommen.
Was genau war übrigens Placebo?
Nur die mit 2x Kochsalz oder auch jene, die nach 2 Spritzen gerade auf Kochsalz waren? Ich verstehe den Aufbau des Versuchs nicht. Im Nature Paper wird das letztendlich klarer. Scheint ein richtiger Placeboarm gewesen zu sein. Aus den Beschreibungen dieses Zulassungsdokuments erschließt sich mir das nicht.
Nebenwirkungen nach bis zu 7 Tagen, sieht bei Verum im Vergleich zu Placebo bei allen Nebenwirkungen richtig bescheiden aus, obwohl ich nicht wirklich weiß, was hier noch richtiges Placebo ist, da irgendwie doch jeder das Produkt bekommen hat, früher oder später.
Nebenwirkungen nach bis zu 28 Tagen
Scheint nach 28 Tagen in beiden Gruppen ausgeglichen, wobei da schon echt viele Nebenwirkungen im Plazeboarm sind.
Wenn man nach 2x saRNA anschließend 2x Kochsalz zugewiesen wurde und dann mit langfristigen Nebenwirkungen als Placebo galt, hat man die Placebowerte ruiniert.
Der Sinn des Studiendesigns erschließt sich mir absolut nicht.
Publikation zur Studie
ARCT-154-J01 (Untersuchungszeitraum, läuft seit November 2022; Datenstand 27. März 2023)
Die Probanden waren gesunde Erwachsene im Alter von ≥18 Jahren,
die 2 Dosen des SARS-CoV-2-Impfstoffs (Comirnaty oder Spikevax, beide monovalent [gegen den Originalstamm]) als Erstimpfung und Comirnaty (monovalent [gegen den ursprünglichen Stamm]) als Auffrischungsimpfung ≥3 Monate zuvor erhalten hatten
(Zielstichprobengröße: 780 Probanden [390 in der Kostaive-Gruppe, 390 in der Comirnaty-Gruppe]).
Wir haben hier gleich vier Probleme
Nur Japaner = Nicht auf Europäer übertragbar.
Nur gesunde Menschen = nicht auf vulnerable Gruppen übertragbar.
Alles schon “grundimmunisiert” + geboosert mit modRNA
möglicher IgG4-shift = Tolleranz gegen das Spike-Protein bereits vorhanden, was akute Nebenwirkungen durch das Spike maskieren kann.
Antikörper gegen das von Kostaive gebildete Spike, was akute Nebenwirkungen maskieren kann.
Daten ungeeignet für Ungeimpfte.
Eine Einzeldosis von
5 µg Kostaive
oder 0,3 ml Comirnaty
wurde intramuskulär verabreicht.
Man schaut hier also, wer ist der bessere Booster, um den Markt doch noch zu übernehmen?
Die Nebenwirkungen nach bis zu 7 Tagen sind auf den ersten Blick häufiger als bei Comirnaty und das will schon was heißen.
Für ein bisschen mehr nutzlose IgG muss man eben ein wenig mehr leiden.
Nebenwirkungen nach bis zu 28 Tagen
Macht grob den Eindruck, als wenn der “Klassiker” Comirnaty langfristigere Nebenwirkungen als die saRNA-Plörre Kostaive machen würde. Im Großen und Ganzen nehmen sich die beiden Injektionen aber nichts.
Es gab keine Todesfälle.
Dazu gibt es mittlerweile eine publizierte Studie:
Publikation zur Studie?
Es gibt noch weitere Paper, welche die saRNA mit BNT162B2 vergleichen. Ich bin mir nicht ganz sicher, ob die auch noch zu dieser Studie gehören und welches Paper wirklich zur Studie gehört.
Einen Vergleich mit dem Astra-Vektorspritzstoff gibt es auch
Fazit:
Keine Informationen wie lange die saRNA überhaupt “schützen” soll.
Keine Belege, dass sich vielleicht Erinnerungszellen im Knochenmarkt bilden oder auch nicht.
Teils ziemlich seltsames Studiendesign, das sich mir aus dem Dokument nicht wirklich erschließt.
Antikörpertiter scheint schnell wieder abzusinken, was ich als gutes Zeichen sehe, dass die Spike-Produktion bei den meisten nicht lange anhält.
Kurzfristig mehr Nebenwirkungen als die modRNA-”Klassiker”, langfristig scheinen sich die Produkte nichts zu nehmen auch was ihre Nutzlosigkeit angeht.
Ali F, Elserafy M, Alkordi MH, Amin M. ACE2 coding variants in different populations and their potential impact on SARS-CoV-2 binding affinity. Biochem Biophys Rep. 2020 Dec;24:100798. doi: 10.1016/j.bbrep.2020.100798. Epub 2020 Aug 20. PMID: 32844124; PMCID: PMC7439997. https://pubmed.ncbi.nlm.nih.gov/32844124/
Warum huACE2-Mäuse so wichtig gewesen wären
Das Paul-Ehrlich Institut (PEI) schrieb in seinem Paper folgendes.



































Einen Fehler kann man machen. Wer den gleichen Fehler wieder macht ist dumm!
Weisst du ob man nach IgG4 geschaut hat? Bei BNT162b2 wissen wir nach Mehrfachgabe schwenkt das Immunsystem um. Wie sieht das aus, wenn das Immunsystem einfach über einen längeren Zeitraum mit Spikeprotein quasi dauerhaft konfrontiert wird?