Konzeptpapier für die Entwicklung eines Leitfadens zu Qualitätsaspekten von mRNA-Impfstoffen für die Veterinärmedizin
Die EU ist zumindest bei Tieren dabei sich über Qualität von modRNA-Imofstoffen Gedanken zu machen
https://x.com/VaccineMole/status/1877096196461728122
Guideline on quality aspects of mRNA vaccines for veterinary use | European Medicines Agency (EMA)
Seit vier Jahren werden diese Art Produkte an Menschen getestet, bevor sie an Tieren angewendet werden. Man kann also davon ausgehen: Wenn diese Daten jetzt für Tiere nicht verfügbar sind, waren und sind sie es für Menschen erst recht nicht gewesen.
Guidline Tiere
Schauen wir und das Dokument einmal näher an:
“In diesem Konzeptpapier wird die Notwendigkeit der Erstellung einer Leitlinie zu den Qualitätsaspekten von mRNA-Impfstoffen angesprochen.”
Wenn man eine Leitlinie erstellen muss, scheint es sie wohl noch nicht zu geben?
“Im Bereich der Humanarzneimittel ist die Zahl der Anträge auf klinische Studien und der Marktzulassungen für mRNA-haltige Produkte in den letzten Jahren erheblich gestiegen, und während der COVID-19-Pandemie wurden viele Erfahrungen mit mRNA-Impfstoffen gesammelt. Es wird erwartet, dass solche Entwicklungen auch im Bereich der Impfstoffe für veterinärmedizinische Zwecke zu beobachten sein werden.
Aus analytischer und regulatorischer Sicht unterscheiden sich mRNA-Impfstoffe von den meisten derzeit zugelassenen Impfstoffen. mRNA-Impfstoffe gegen Infektionskrankheiten müssen mit den allgemeinen Leitlinien für Tierimpfstoffe übereinstimmen, doch diese Technologie wird in den bestehenden Leitlinien nicht vollständig berücksichtigt. Daher wird vorgeschlagen, eine Leitlinie zu erstellen, die sich mit diesen spezifischen Aspekten in Bezug auf den Herstellungsprozess, die Charakterisierung, die Spezifikationen und die analytische Kontrolle sowie die Definition des Wirkstoffs und des Endprodukts für mRNA-Impfstoffe befasst. Der Anwendungsbereich der Leitlinie wird auf mRNA-Impfstoffe gegen Infektionskrankheiten (einschließlich selbstverstärkender mRNA) beschränkt sein. mRNA-basierte Therapeutika werden nicht in den Anwendungsbereich des Dokuments fallen.“
mRNA Impfstoffe unterscheiden sich von Impfstoffen gegen Infektionskrankheiten! Sie müssen anders bewertet werden!
Die WHO Richtlinien, die mRNA-Impfstoffe wie klassische Impfstoffe behandeln gelten wohl nicht für Tiere?
Irina Vlatkovic von BioNTech beschreibt das im Mai 2021 so:
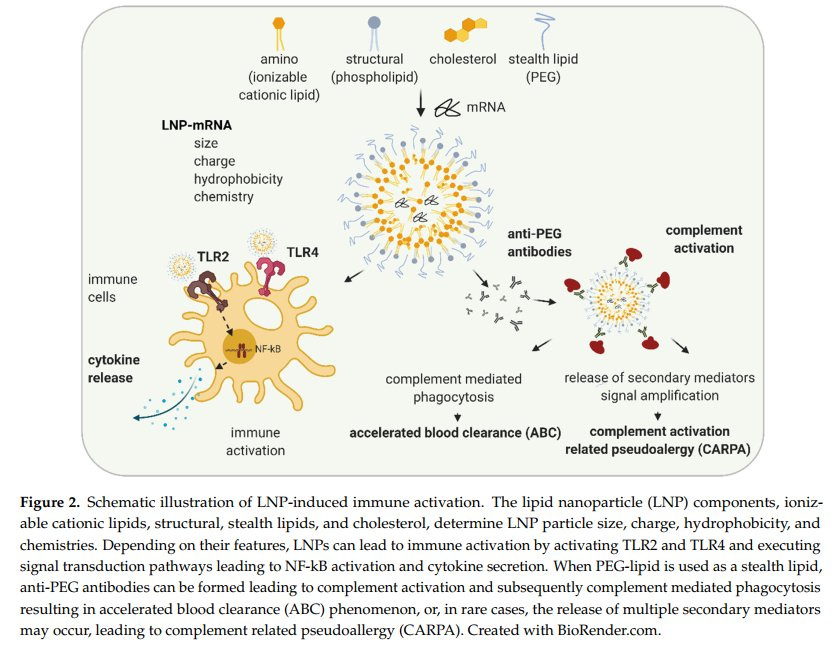
"Die hier beschriebenen Sicherheitserwägungen für Anwendungen der Proteinersatztherapie (RPRT) gelten auch für alle LNP-mRNA-basierten Nicht-Impfstoff- und Nicht-Immuntherapie-Anwendungen wie monoklonale oder bispezifische Antikörpertherapien, die in der Onkologie oder bei Infektionskrankheiten eingesetzt werden.
Im Vergleich zu Impfstoffen und Immuntherapien erfordern LNP-mRNA-Anwendungen, die keine Immuntherapien sind, eine größere Anzahl präklinischer Tests, wobei der Schwerpunkt auf der Sicherheit liegt. Auf der Grundlage der zuvor erörterten Mechanismen der Immunaktivierung durch LNP-mRNAs würden die präklinischen Tests solcher Studien optimalerweise Folgendes umfassen: (1) Korrelation einer steigenden LNP-mRNA-Dosis mit der Sekretion von Zytokinen und Chemokinen, (2) Komplementaktivierung, (3) Auswirkungen einer wiederholten Verabreichung mit Untersuchung von Anti-Drogen-Antikörpern, (4) Marker für akute Lebertoxizität und potenzielle Lipidakkumulation und (5) Histopathologie des Zielorgans.
Leider konzentriert sich die derzeitige Literatur über präklinische Studien zur Nicht-Immuntherapie mit LNP-mRNA hauptsächlich auf die Wirksamkeit des Medikaments in Mausmodellen und bietet nur begrenzte Daten zur Sicherheit."3 4
Die geänderten Arzneimittelgesetze5 scheinen bei Tierimpfstoffen wohl nicht zu gelten?
“Derzeit gibt es keine Richtlinie, die die Qualitätsanforderungen für Regulierungsbehörden und die Industrie in Bezug auf mRNA-haltige Impfstoffe widerspiegelt. Angesichts der wissenschaftlichen Entwicklungen der letzten Jahre, einschließlich der Erfahrungen, die während der COVID-Pandemie im Bereich der Humanarzneimittel gesammelt wurden, und der ersten erwarteten Einreichungen für mRNA-Impfstoffe für den Veterinärbereich, sollte eine solche Richtlinie entwickelt werden, um eine angemessene Unterstützung bei der Entwicklung und Herstellung von mRNA-Impfstoffen für den Veterinärbereich zu gewährleisten. “
Welche Erfahrungen meint die EU?
Gute oder schlechte Erfahrungen?
DNA-Verunreinigungen?
Rückstände aus der Produktion?
Produktionsverfahren?
Lipidtoxizität?
Es ist schön, dass man sich bei der EU mehr Sorgen, um die Gesundheit von Tieren als von Menschen macht. So eine Kuh ist möglicherweise einfach mehr wert als ein Mensch. Der Wirtschaftliche Schaden beim Tod eines Nutztieres könnte höher sein, als wenn ein unnützer Esser endlich sozialverträglich ablebt.
Impfstoffe und ihr Herstellungsprozess sind eine neuartige Technologie, und die daraus resultierenden Produkte unterscheiden sich von anderen Arten von Impfstoffen.
Aber nur bei Tieren!
Sie bestehen aus mRNA (nicht replizierend oder selbstverstärkend, nukleosidmodifiziert oder nicht), die in Lipidnanopartikeln oder anderen Arten von Verabreichungssystemen verkapselt ist, und für diese neuartigen Produkte können spezifische Qualitätsaspekte gelten.
Vor allem bei den Lipiden, die NICHT registriert sind6 und für die es keine Qualitätskriterien gibt. Wäre auch nett, wenn die Lipide für Tierimpfungen biologisch abbaubar wären, damit sie nicht in der Nahrungskette enden?7
Man sollte vielleicht auch prüfen, ob die Lipide im Notfall in der Falle denaturiert werden:
Da stellt sich die Frage, wie die Franzosen Enten schon damit spritzen können9, wenn es doch gar nicht zugelassen ist? Ist Frankreich noch in der EU oder kann jetzt doch jeder machen, was er will?
Diese Art von Impfstoff kann gegenüber der direkten Inokulation des Antigens selbst einige Vorteile haben, z. B. kann er eine breitere Stimulation des Immunsystems bewirken, sowohl zellulär als auch humoral, einschließlich der Stimulation einer zytotoxischen T-Zell-Antwort. Er kann auch Vorteile gegenüber der Verwendung von abgeschwächten Lebendmikroorganismen haben, z. B. die Vermeidung des Risikos eines Krankheitsausbruchs durch eine mögliche Rückkehr zur Virulenz. Darüber hinaus ist die Entwicklung und Herstellung von mRNA-Impfstoffen wahrscheinlich leichter anpassbar und skalierbar und daher kostengünstiger als bei den herkömmlichen Impfstofftypen.
Kann und wahrscheinlich klingt nicht wirklich sicher und überzeugt. Es sind Konditionalsätze, die eine Möglichkeit beschreiben, die nicht eintreffen muss.
Wir haben es hier also grammatikalisch mit irreale Bedingungen in der Gegenwart zu tun.10
Das ist der Augenblick, in welchem der Grammatikunterricht der fünften und sechsten Klasse Leben retten könnte.
Außerdem bietet sie einen größeren Spielraum für andere Verabreichungsarten.
Aerosole vielleicht11? Cremes12?
Darüber hinaus kann mRNA als Impfstoff-Plattformtechnologie betrachtet werden, die für eine schnelle Reaktion auf neu auftretende Krankheitsbedrohungen von Vorteil sein kann. Die vorgeschlagene Richtlinie wird Informationen und regulatorische Überlegungen zu den folgenden Schlüsselaspekten der Herstellung und Qualitätskontrolle enthalten:
Definitionen von Ausgangsmaterialien, Wirkstoff, Zwischenprodukt des Endprodukts, Hilfsstoffen und Endprodukt
Kontrolle der Ausgangsmaterialien (lineare DNA-Vorlage für die Herstellung des mRNA-Transkripts und gegebenenfalls Plasmid-DNA)
Entwicklung einer integrierten Kontrollstrategie für den Herstellungsprozess des Wirkstoffs und des Endprodukts, um eine gleichbleibende Qualität der mRNA-Impfstoffe auf der Grundlage relevanter kritischer Qualitätsattribute (CQAs) sicherzustellen
Charakterisierungsansätze, einschließlich der Untersuchung des Verunreinigungsprofils
Nur zur Info, das fehlt bei den Humanvarianten bisher, sonst hätte man das übernehmen können.
Noch besser, das ist bei den humanen Varianten EXPLIZIT per Vertrag ausgeschlossen:
„Der teilnehmende Mitgliedsstaat erkennt an, dass der Impfstoff und die mit dem Impfstoff zusammenhängenden Materialien sowie ihre Komponenten und Bestandteile aufgrund der Notsituation der COVID-19-Pandemie rasch entwickelt und nach der Bereitstellung des Impfstoffs an die teilnehmenden Mitgliedstaaten im Rahmen des APA weiter untersucht werden. Der teilnehmende Mitgliedsstaat erkennt ferner an, dass die langfristigen Auswirkungen und die Wirksamkeit des Impfstoffs derzeit nicht bekannt sind und dass der Impfstoff unerwünschte Wirkungen haben kann, die derzeit nicht bekannt sind. Weiterhin, soweit anwendbar, erkennt der Teilnehmerstaat an, dass der Impfstoff nicht in Serie produziert werden wird.”
Man hat also aus den Fehlern der Menschenversuche gelernt. Normalerweise ist das eigentlich anders herum, erst die Tierversuche. Immerhin hat man daraus gelernt, auch wenn man es für die Humanprodukte niemals nie nimmer nich zugeben würde.
• Strategie zur Reinheitskontrolle: prozess- und produktbezogene Verunreinigungen sowie andere potenzielle Kontaminanten und Methoden zu deren Kontrolle
Wie DNA oder dsRNA, die man offiziell immer noch bestreitet bzw. bestreitet, dass es ein Problem ist?
• Wirkstoff- und Fertigproduktspezifikationen
• Wirksamkeitstests: Zur Kontrolle verschiedener Aspekte der Wirksamkeit, einschließlich der Funktionalität (z. B. mRNA-Expression, Proteinexpression in transduzierten Zellen), können verschiedene Tests erforderlich sein
Ob die Humanvarianten wirksam waren streitet man sich aktuell noch. Eine Wirkung hatten sie, ob es die gewünschte Wirkung war, kommt auf den Standpunkt an. Es gab jedenfalls keinen Infektionsschutz.
• Verschiedene Aspekte in Bezug auf Formulierungsstrategien, einschließlich Überlegungen zur Bildung und Herstellungsmethode von Lipidnanopartikeln (LNPs) oder anderen Verabreichungssystemen und deren Stabilität
DAS wird die Hersteller so gar nicht erfreuen:
„die Art der Verunreinigungen von Charge zu Charge stark variieren, insbesondere wenn sie in unterschiedlichen Größenordnungen und nach unterschiedlichen Verfahren hergestellt werden.“14
• Stabilitätsstudien für Wirkstoffe und Fertigprodukte
In der vorgeschlagenen Richtlinie werden auch relevante regulatorische Überlegungen und Herausforderungen in Bezug auf folgende Aspekte erörtert:
• die Entwicklung und Erprobung multivalenter mRNA-Impfstoffe sowie Änderungen in der mRNA-Zusammensetzung
• selbstverstärkende mRNA (sa-mRNA), verpackt in LNPs
• andere Verabreichungssysteme (d. h. nicht-LNPs)
• die Nutzung von Plattformtechnologien für neue Ziele
Das WHO-Leitliniendokument, Anhang 3 „Bewertung der Qualität, Sicherheit und Wirksamkeit von Messenger-RNA-Impfstoffen zur Vorbeugung von Infektionskrankheiten: regulatorische Überlegungen“, WHO-Fachbericht, Reihe Nr. 1039, 2022, wird berücksichtigt. Darüber hinaus wird gegebenenfalls auf aktuelle und zukünftige Kapitel und/oder Monographien der Europäischen Pharmakopöe verwiesen.
Damit ist wahrscheinlich USP gemeint, die sind noch am diskutieren, wie man die Plörren testen könnte.15 Aktuell macht da jeder, was er will, weil jeder andere Verfahren mit anderen Verunreinigungen hat.
Der Ausschuss für Tierarzneimittel (CVMP) empfiehlt der Arbeitsgruppe für immunologische Arzneimittel (IWP), die Ausarbeitung einer Leitlinie zu Qualitätsaspekten von mRNA-Impfstoffen für den tierärztlichen Gebrauch zu erörtern. Die oben genannten Punkte werden berücksichtigt und mögliche Lösungsansätze können einbezogen werden, sofern diese bekannt sind.
Lösungsansätze, soweit bekannt… Einiges ist NICHT lösbar, aus biologischen Gründen.16
Bei Tier-mdRNA-Produkten nimmt man sich ZWEI JAHRE Zeit überhaupt mal regulatorische Grundlagen zu erarbeiten. ZWEI JAHRE.
Warum?
Hat doch bei den COVID-Plörren auch binnen 12 Monaten funktioniert.
Da muss es doch schon Dokumente geben, die man nutzen kann?
Oder etwa nicht?
Muss man da vielleicht noch ein paar Gesetze ändern?
Oder braucht man eine Notfallzulassung?
Die Richtlinie wird die Anforderungen an die Regulierungsbehörden und die Pharmaindustrie in Bezug auf die Qualitätsaspekte von mRNA-haltigen Impfstoffen klären und die Konzepte der jüngsten Entwicklungen im Bereich der mRNA-Impfstoffe für den menschlichen Gebrauch berücksichtigen. Insgesamt wird erwartet, dass sich die Richtlinie positiv auf die Entwicklung von auf mRNA basierenden Tierimpfstoffen auswirken und die Einreichung und Zulassung von Tierimpfstoffen erleichtern wird. Die Richtlinie kann zu einer besseren Verfügbarkeit von Tierimpfstoffen beitragen und damit der öffentlichen Gesundheit und der Tiergesundheit zugutekommen.
Hier kommen die Menschenversuchen den Tieren zugute. Satanische Umkehr auch hier? Wäre nicht die eigentliche Konsequenz, diese Produkte komplett zu verbieten, erst recht für unschuldige Tiere?
BioNTech hat sich aber auf DEUTLICH ältere WHO Richtlinien bezogen. Leider sind diese nicht verlinkt und auch keine Links angegeben.
Da gibt es zudem schon neuere Guidelines. Warum bezieht man sich auf die von 2020, wenn es schon eine von 2021 gibt?
Guideline Menschen
Eine Guideline von 2023… Sollte die nicht schon 2019 existiert haben?
Schauen wir und diese Guideline mal im Vergleich zur jener für Tiere an:
In diesem Konzeptpapier wird die Notwendigkeit der Erstellung einer Richtlinie zu den Qualitätsaspekten von mRNA-Impfstoffen behandelt. Die Zahl der Anträge auf klinische Studien für Humanprodukte und der Anträge auf Marktzulassung für mRNA-haltige Produkte ist in den letzten Jahren erheblich gestiegen und wird voraussichtlich in Zukunft weiter steigen. Darüber hinaus wurden während der COVID-19-Pandemie viele Erfahrungen mit mRNA-Impfstoffen gesammelt. Aus analytischer und regulatorischer Sicht sind mRNA-Impfstoffe interessant, da ihre Klassifizierung vom Ziel und/oder davon abhängt, ob sie chemisch oder biologisch gewonnen werden. mRNA-Impfstoffe gegen Infektionskrankheiten müssen den allgemeinen Leitlinien für Humanimpfstoffe entsprechen, jedoch wird die neue Technologie in den bestehenden Leitlinien nicht vollständig berücksichtigt. Es wird daher vorgeschlagen, eine Leitlinie zu erstellen, die sich mit diesen spezifischen Aspekten in Bezug auf den Herstellungsprozess, die Charakterisierung, die Spezifikationen und die analytische Kontrolle sowie die Definition des Wirkstoffs und des Endprodukts für mRNA-Impfstoffe zur Vorbeugung von Infektionskrankheiten befasst. Der Geltungsbereich der Richtlinie wird auf mRNA-Impfstoffe gegen Infektionskrankheiten (einschließlich selbstverstärkender mRNA) beschränkt sein. mRNA-basierte Therapeutika werden nicht in den Geltungsbereich des Dokuments fallen. Es ist nicht beabsichtigt, spezifische Anforderungen für mRNA-Impfstoffe zu behandeln, die in klinischen Studien eingesetzt werden sollen, jedoch können die beschriebenen wissenschaftlichen Grundsätze auch während der pharmazeutischen Entwicklung anwendbar sein.
Was stand bei den Tierprodukten?
Aus analytischer und regulatorischer Sicht unterscheiden sich mRNA-Impfstoffe von den meisten derzeit zugelassenen Impfstoffen. mRNA-Impfstoffe gegen Infektionskrankheiten müssen mit den allgemeinen Leitlinien für Tierimpfstoffe übereinstimmen, doch diese Technologie wird in den bestehenden Leitlinien nicht vollständig berücksichtigt.
Die EU hat also generell schon mal eingesehen, dass die neue Technologie da irgendwie nicht vollständig berücksichtigt wird. Das würden unsere Politiker natürlich nie zugeben.
Der Knaller ist aber:
Derzeit gibt es keine Richtlinie, die die Qualitätsanforderungen für Regulierungsbehörden und die Industrie in Bezug auf mRNA-haltige Impfstoffe widerspiegelt.
Und das nach 3 Jahren auf dem Markt?!
Ohne Richtlinie?
Wie konnte das passieren?
mRNA-Impfstoffe und ihr Herstellungsprozess sind neuartig und unterscheiden sich von anderen Impfstoffarten. Sie bestehen aus mRNA (entweder nicht replizierend oder selbstverstärkend und entweder nukleosidmodifiziert oder nicht), die in Lipidnanopartikeln oder anderen Arten von Verabreichungssystemen verkapselt ist. Während die Herstellung von mRNA-Impfstoffen mit den allgemeinen Leitlinien für Humanimpfstoffe übereinstimmen muss, können für diese neuartigen Produkte spezifische Qualitätsaspekte gelten.
Die vorgeschlagene Richtlinie wird sich, soweit relevant, an der Struktur von CTD-Modul 3 orientieren. Darüber hinaus werden Überlegungen zu Endprodukten (z. B. Auswahl der Hilfsstoffe, Formulierungs- und Herstellungsaspekte) angestellt, die für Endproduktformulierungen mit mRNA relevant sind.
Die Modul 3 Daten sind jene, die die FDA nicht herausrücken wollte und geklagt hat.18 19Warum wohl? Bisher wissen wir nicht, wie schlimm es da aussieht.
Die FDA hat jedenfalls verloren und muss die Daten rausrücken. Es bleibt also spannend, inwieweit die Plörren den Regeln von Modul 3 (nicht) entsprechen.
Die vorgeschlagene Richtlinie wird Informationen und regulatorische Überlegungen zu den folgenden Schlüsselaspekten der Herstellung und Qualitätskontrolle enthalten:
Wird enthalten ist ein Futur-Konstrukt. Es enthielt diese Richtlinien also während der Plandemie nicht.
• Definitionen von Ausgangsmaterialien, Wirkstoff, Zwischenprodukt des Endprodukts, Hilfsstoffen und Endprodukt
• Kontrolle der Ausgangsmaterialien (lineare DNA-Vorlage für die Herstellung von mRNA-Transkript Transkripts und gegebenenfalls Plasmid-DNA)
• Entwicklung einer integrierten Kontrollstrategie für den Wirkstoff und den Herstellungsprozess des Endprodukts zur Gewährleistung einer gleichbleibenden Qualität von mRNA-Impfstoffen auf der Grundlage relevanter kritischer Qualitätseigenschaften (CQAs)
• Charakterisierungsansätze einschließlich Untersuchung des Verunreinigungsprofils : prozess- und produktbezogene Verunreinigungen sowie andere potenzielle Kontaminanten und Methoden zu deren Kontrolle
• Wirkstoff- und Fertigproduktspezifikationen
• Wirksamkeitstests: Zur Kontrolle verschiedener Aspekte der Wirksamkeit, einschließlich der Funktionalität, können verschiedene Tests erforderlich sein (z. B. mRNA-Expression, Expression in transduzierten Zellen)
• Verschiedene Aspekte in Bezug auf die Formulierungsstrategien, einschließlich Überlegungen zur Bildung und Herstellungsmethode von Lipidnanopartikeln (LNPs) und ihrer Stabilität
• Stabilitätsstudien für Wirkstoffe und Fertigprodukte
2021-2022 hätte man die EU bei solchen Behauptungen auf den Sozialen Medien gesperrt und zum Schwurbler und Querdenker erklärt. All das wollten die Kritiker von Anfang an.
OK, man hat die Forderungen übernommen, das ist positiv, aber leider viele Jahre und viele Tote zu spät.
In der vorgeschlagenen Richtlinie werden auch relevante regulatorische Überlegungen und Herausforderungen in Bezug auf
• die Entwicklung und Prüfung von zwei- und mehrwertigen Impfstoffen sowie Änderungen bei den bestehenden mRNA-Impfstoffstämmen
• selbstverstärkende mRNA (sa-mRNA), verpackt in LNPs
• andere Verabreichungssysteme (d. h. nicht LNPs)
• die Verwendung von Plattformtechnologie/Ansatz des Vorwissens für neue Ziele
Das WHO-Leitliniendokument, Anhang 3 „Bewertung der Qualität, Sicherheit und Wirksamkeit von 69 Messenger-RNA-Impfstoffen zur Vorbeugung von Infektionskrankheiten: regulatorische Überlegungen“, 70 WHO-Fachbericht, Reihe Nr. 1039, 2022, wird berücksichtigt. Darüber hinaus wird gegebenenfalls auf aktuelle und zukünftige Kapitel und/oder Monographien des Europäischen Arzneibuchs verwiesen.
Die Arbeitsgruppe für biologische Präparate empfiehlt die Erstellung einer Richtlinie zu den Qualitätsaspekten von mRNA-Impfstoffen.
2021 wäre man wegen solcher Forderungen mundtot gemacht worden und hätte seine Zulassung als Arzt verloren.
“Dieses Konzeptpapier wird für einen dreimonatigen öffentlichen Konsultationszeitraum veröffentlicht.
Kleine Erinnerung: Dieser Zeitpunkt ist am 20. September 2023 abgelaufen. WO IST DAS DOKUMENT?
BWP wird alle während der öffentlichen Konsultation zum Konzeptpapier eingegangenen Kommentare bei der Ausarbeitung des Entwurfs der Leitlinie berücksichtigen. Der Entwurf der Leitlinie wird für einen sechsmonatigen öffentlichen Konsultationszeitraum veröffentlicht. BWP wird alle während der öffentlichen Konsultation zum Entwurf der Leitlinie eingegangenen Kommentare bei der Ausarbeitung des endgültigen Leitlinientextes berücksichtigen. Es wird erwartet, dass die endgültige Leitlinie sechs Monate nach der Veröffentlichung nach der Annahme durch den CHMP in Kraft tritt.
Wo findet man diese Informationen?
Die Richtlinie wird die Anforderungen an die Regulierungsbehörden und die Pharmaindustrie in Bezug auf die Qualitätsaspekte von mRNA-haltigen Impfstoffen unter Berücksichtigung der Konzepte der jüngsten Entwicklung klären. Die Richtlinie wird keine neuen Anforderungen an bereits zugelassene und auf dem Markt befindliche Arzneimittel einführen.
Auch wenn sich herausstellen sollte, dass die COVID-Plörren nach den neuen Regeln nie hätten zugelassen werden dürfen, wird man die Hersteller nicht behelligen und sie dürfen ihren schmutzigen Dreck weiter verkaufen.
Wer hätte das gedacht.
Patienten und Ärzte fehlen da irgendwie bei den interessierten Parteien.
Und erneut keine Links oder Referenzen.
Welches sind die relevanten ICH Guidelines? Die aktuellen Plörren sind NICHT ICH registriert. Is wohl nicht relevant.
Es gibt ein Folgedokument:
Auch hier ist die Deadline bereits abgelaufen.
“Während der Pandemie der Coronavirus-Krankheit 2019 (COVID-19) haben die EMA Emergency Task Force (ETF) und der CHMP zwei Leitfäden verabschiedet. Das erste Dokument behandelte die regulatorischen klinischen Anforderungen für die Zulassung von COVID-19-Impfstoffen und wurde im November 2020 veröffentlicht (EMA/592928/2020).
Das zweite Dokument behandelte die qualitativen, nichtklinischen und klinischen regulatorischen Anforderungen für Impfstoffe, die Schutz vor Varianten des schweren akuten Atemwegssyndroms Coronavirus 2 (SARS-CoV-2) bieten sollen, und wurde im Februar 2021 veröffentlicht (EMA/117973/2021).
Seit der Veröffentlichung dieser Dokumente gab es mehrere Entwicklungen im Bereich der COVID-19-Impfstoffe. Parallel dazu entwickeln sich die vorherrschenden zirkulierenden Varianten von SARS-CoV-2 im Laufe der Zeit weiter, und die Immunität der Bevölkerung der Europäischen Union (EU) gegenüber früheren und aktuellen Varianten hat sich aufgrund natürlicher Exposition und Impfkampagnen erhöht.
Die Erfahrungen mit Anträgen auf wissenschaftliche Beratung und auf Marktzulassung seit 2021 haben gezeigt, dass eine Überarbeitung der Leitliniendokumente erforderlich ist. Es wird vorgeschlagen, die beiden Leitfäden in einer einzigen Leitlinie zusammenzufassen, die die nichtklinischen und klinischen Aspekte der Entwicklung von Impfstoffen gegen COVID-19 abdeckt. Es ist beabsichtigt, die Qualitätsaspekte von COVID-19-Impfstoffen in einer separaten Leitlinie zu behandeln (nicht im Rahmen dieses Konzeptpapiers).”
“Die aktuellen Leitfäden wurden zu einer Zeit entwickelt, als die zirkulierenden Virusvarianten noch eng mit dem ursprünglichen (Wuhan-)Stamm verwandt waren und als die klinische Wirksamkeit der verwendeten COVID-19-Impfstoffe in großen klinischen Studien vor der Zulassung bewertet worden war.
Der regulatorische Ansatz zur Entwicklung von Impfstoffen gegen weitere Varianten wurde im zweiten Dokument vom Februar 2021 erörtert. Aufgrund der weit verbreiteten Verfügbarkeit von Impfstoffen, der Aktualisierung des Impfstoffinhalts in Übereinstimmung mit epidemiologischen Daten und der variablen Immunität der EU-Bevölkerung gegenüber den neuesten Varianten, die frühere natürliche Expositionen und Impfungen widerspiegelt, unterscheidet sich die Impfstoffentwicklungslandschaft nun stark von der Situation zum Zeitpunkt der Veröffentlichung der vorherigen Leitlinien.
Diese Faktoren haben alle erhebliche Auswirkungen auf die Gestaltung durchführbarer klinischer Studien. Beispielsweise sind placebokontrollierte Wirksamkeitsstudien in Subpopulationen, für die eine Impfung empfohlen wird, nicht mehr möglich, was dazu führt, dass man sich auf Immunobridging verlässt, um auf die Wirksamkeit des Impfstoffs zu schließen, wofür Leitlinien zu primären Immunparametern und Akzeptanzkriterien erforderlich sind.
Es liegen zahlreiche Belege für die Verwendung neutralisierender Antikörper als primärer Immunparameter für das Immunobridging vor. Darüber hinaus gibt es einige anerkannte Situationen, in denen es möglicherweise nicht notwendig ist, vor der Zulassung klinische Studien durchzuführen (z. B. wenn die Zusammensetzung eines zugelassenen Impfstoffs nur geändert wird, um das/die [kodierte(n)] Antigen(e) zu ändern).
Keine klinischen Tests mehr möglich, also suchen wir uns Surrogatparameter, die wir nicht näher benennen.
Wenn man “nur” das Spike-Gen gegen ein anderes Gen eines möglicherweise toxischeren Proteins austauscht, muss man dieses Protein nicht charakterisieren. WIr ignorieren komplett die Erkenntnisse der Proteinbiochemie. Was sind schon ein paar Aminsosäureaustausche unter Freunden oder ein komplett anderes Eiweiss?
Bei so viel Inkompetenz gruselt es mich.
Darüber hinaus wurden seit 2021 neue Impfstoffkonstrukte vorgeschlagen, darunter die mögliche Entwicklung von mukosalen (nasal verabreichten) Impfstoffen und Impfstoffen auf der Grundlage anderer Plattformen.
Darüber hinaus wurden einige frühe Vorschläge für Impfstoffe gemacht, die nicht nur COVID-19, sondern auch Krankheiten verhindern sollen, die durch verwandte Sarbecoviren verursacht werden.
Die aktuellen Leitlinien befassen sich nicht mit der Entwicklung solcher Produkte.
Die aktuellen Leitlinien befassen sich nicht mit der Durchführung und Berichterstattung von Studien zur Wirksamkeit von Impfstoffen und den vielen Schwierigkeiten, die es bei der Beschaffung zuverlässiger Daten, insbesondere markenspezifischer Daten, geben kann. Es besteht die Notwendigkeit, die Durchführbarkeit und das mögliche Design solcher Studien zu prüfen.
Schließlich enthalten die aktuellen Leitlinien (EMA/592928/2020 und EMA/117973/2021) nur Empfehlungen der Stufe zu nichtklinischen Anforderungen für die Zulassung von Impfstoffen gegen Varianten, und diese Informationen sollten im Zusammenhang mit jeder künftigen Zulassung von COVID-19-Impfstoffen aktualisiert werden. “
Jahr später, als notwendig gewesen wäre. Die Regeln kommen dann, wenn sie keiner mehr braucht?
“Die folgenden Elemente der aktuellen Leitfäden müssen überarbeitet oder hinzugefügt werden:
• Neuartige Plattformen, die für SARS-CoV-2-Impfstoffe entwickelt werden, einschließlich neuer Verabreichungswege;
• Anforderungen für die Änderung der Antigenzusammensetzung von/Antigene, die von zugelassenen Impfstoffen exprimiert werden;
• Ableitung der Wirksamkeit durch Immunobridging;
• Impfstoffe, die vor mehreren Sarbecoviren, einschließlich SARS-CoV-2, schützen sollen;
• Studien zur Wirksamkeit von Impfstoffen;
• Nichtklinische Studien und, soweit ethisch vertretbar, Provokationsstudien am Menschen zur Unterstützung der Wahrscheinlichkeit der Wirksamkeit von Impfstoffen;
• Anforderungen an die pädiatrische Entwicklung von SARS-CoV-2-Impfstoffen;
• Redaktionelle und strukturelle Änderungen zur Straffung und Verbesserung der Lesbarkeit.”
“Die ETF empfiehlt, die bestehenden Leitfäden zu COVID-19-Impfstoffen unter Berücksichtigung der oben genannten Punkte zu überarbeiten. “
Die Gene des Spike-Proteins wurden zwar schon mehrfach MASSIV verändert, ohne das Protein biochemisch zu charakterisieren, aber man sollte man darüber reden.
Die Kinder werden zwar schon mit der Plörre vergiftet, aber pädiatrische Entwicklungen wären vielleicht schon ganz nett (für die Kinder, welche bis dahin überlebt haben).
“Die überarbeitete Richtlinie wird Aspekte der nichtklinischen und klinischen Entwicklung neuer SARS-93-CoV-2- oder verwandter Sarcovirus-Impfstoffe behandeln, einschließlich Fragen, die in den aktuellen Leitfäden nicht behandelt werden.
Diese Richtlinie wird Antragsteller für neue Impfstoffe von der Produktentwicklung bis zur Zulassung begleiten.
Die überarbeitete Richtlinie wird sich auch mit Fragen nach der Zulassung befassen, darunter Änderungen der Antigenzusammensetzung/-expression und die Erhebung von Daten zur Wirksamkeit von Impfstoffen.
Alle vorgesehenen Änderungen werden dazu beitragen, in erster Linie den Bedarf an sicheren und wirksamen Coronavirus-Impfstoffen, auch gegen COVID-19, zu decken, wobei neue wissenschaftliche Erkenntnisse und Lehren aus der COVID-19-Pandemie berücksichtigt werden.”
Nachträglich will man also Richtlinien erstellen, die sich mal um die Antigenzusammensetzung kümmern und die Wirksamkeit erheben. Hat man das bisher nicht gemacht? Was haben die Hersteller da unkontrolliert getrieben.
Überhaupt: Bedarf an sicheren und WIRKSAMEN Coronavirus-Impfstoffen? Das kann man auch so lesen, dass es die bisher gar nicht gab.
Was sind die Lehren aus der Pandemie?
Welche Lehren hat die EU eigentlich gezogen?
Hat sie überhaupt schon Lehren gezogen?
Alles sehr schwammig und für so viel Zeit, die zwischen den beiden Dokumenten verstrichen ist, ein Armutszeugnis.
Wo sind die harten Richtlinien?
Vlatkovic I. Non-Immunotherapy Application of LNP-mRNA: Maximizing Efficacy and Safety. Biomedicines. 2021 May 10;9(5):530. doi: 10.3390/biomedicines9050530. PMID: 34068715; PMCID: PMC8151051. https://pubmed.ncbi.nlm.nih.gov/34068715/
Die kurios verquere Gedankenwelt der modRNA Gläubigen Teil 2
Hier ein weiterer Artikel aus der Reihe: Die kurios verquere Gedankenwelt der modRNA Gläubigen.
Die Bundesregierung setzt heimlich Gesetze und Verordnungen für Covid-19-Impfstoffe außer Kraft
Edgar hat das sehr schön zusammengestellt, hat aber keinen eigenen Substack.
Wie sauber sind die Lipide ALC-0315 und ALC-0159 und sind sie überhaupt korrekt registriert?
Qualitätsstufen für Chemikalien
SM-102 und ALC-0315 sind wahrscheinlich nicht biologisch abbaubar und aktivieren das Immunsystem
Auf Twitter wurde ich auf drei interessante Paper zum Thema kationische Lipide aufmerksam gemacht.
Oude Blenke E, Örnskov E, Schöneich C, Nilsson GA, Volkin DB, Mastrobattista E, Almarsson Ö, Crommelin DJA. The Storage and In-Use Stability of mRNA Vaccines and Therapeutics: Not A Cold Case. J Pharm Sci. 2023 Feb;112(2):386-403. doi: 10.1016/j.xphs.2022.11.001. Epub 2022 Nov 16. PMID: 36351479; PMCID: PMC9637289. https://pubmed.ncbi.nlm.nih.gov/36351479/
Lenk R, Kleindienst W, Szabó GT, Baiersdörfer M, Boros G, Keller JM, Mahiny AJ, Vlatkovic I. Understanding the impact of in vitro transcription byproducts and contaminants. Front Mol Biosci. 2024 Jul 10;11:1426129. doi: 10.3389/fmolb.2024.1426129. PMID: 39050733; PMCID: PMC11266732. https://pubmed.ncbi.nlm.nih.gov/39050733/
Liu MA, Zhou T, Sheets RL, Meyer H, Knezevic I. WHO informal consultation on regulatory considerations for evaluation of the quality, safety and efficacy of RNA-based prophylactic vaccines for infectious diseases, 20-22 April 2021. Emerg Microbes Infect. 2022 Dec;11(1):384-391. doi: 10.1080/22221751.2022.2026742. PMID: 35001848; PMCID: PMC8812800. https://pmc.ncbi.nlm.nih.gov/articles/PMC8812800/







































Was ist denn jetzt dran, dass die mRNA Impfungen eh schon an Hunden und Schweinen seit den 60ern getestet werden?
Ist da ein Unterschied, den ich übersehe zwischen modRNA und mRNA. Erstes klingt gebaut, das andere natürlich.
Ich steh auf dem Schlauch, glaube ich. Wer kann helfen?
Im Jahr 2017 berichtete die australische Therapeutics Goods Administration über Tests von Injektionen von Plasmid-DNA von E. coli an Menschen und Tieren. Für manche ist das vielleicht nichts Neues?
Die australische Behörde für Pestizide und Tierarzneimittel (APVMA) hat einen Antrag eingereicht, um einen neuen Eintrag für Plasmid-DNA (rE. coli DH5α pINGhT) in Anhang 4 des Giftstandards zu erstellen, ohne Ausnahmegrenze.
Beachten Sie insbesondere den CMV-Promoter und die Kanamycin-Kassette, die das Gen exprimiert, das für die vollständige Sequenz der menschlichen Tyrosinase kodiert. Das ist richtig, Sie haben MENSCH gelesen!!
Look which company made and withdrew the vaccine.
In 2017, Australia's Therapeutics Goods Administration reported on Human and Animal testing of injections of Plasmid DNA from E. coli. This might be old news to some?
An application was submitted by the Australian Pesticides and Veterinary Medicines Authority (APVMA) to create a new entry for plasmid DNA (rE. coli DH5α pINGhT) in Schedule 4 of the Poisons Standard, with no exemption cut-off.
Note especially the CMV Promoter and Kanamycin Cassette that expresses the gene coding for the full-length sequence of Human Tyrosinase. That is correct, you read HUMAN !!
https://geoffpain.substack.com/p/tga-e-coli-plasmidgate-2017
Look which company made and withdrew the vaccine.