Schadmechanismen durch Bindung/Blockade von ACE2
ACE2 ist wahrscheinlich an diversen, bisher noch (un-)bekannten pathophysiologischen Prozessen beteiligt
Mögliche Pathologische Schadmechanismen
Bindung des Spike-Proteins an ACE2
Ein pathologischer Mechanismus der Covid-Produkte ist die Produktion oder das in den Körper bringen des Spike-Proteins.
Das Spike-Protein bindet an ACE2, das ist hinlänglich bekannt (https://pubmed.ncbi.nlm.nih.gov/34047452/) und kann somit die entsprechenden Signalkaskaden in allen Organen beeinflussen, welche ACE2 Rezeptoren haben. Aber es muss auch über Spaltung der Furinschnittstelle aktiviert werden. Es gibt also zwei Mechanismen, die ausschlaggebend sind, wie schädlich das Spike ist: Bindung und Aktivierung das Spikes durch Spaltung.
Wie gut und wie stark das Spike-Protein an den ACE2-Rezeptor bindet, hat man auf Einzelmolekülebene gemessen (https://pubmed.ncbi.nlm.nih.gov/38644967/).
Die gute Nachricht des Papers scheint mir zu sein, dass das Spike-Protein vom ACE2 Rezeptor wieder heruntergeholt werden kann und nicht dauerhaft bindet (solange es nicht gespalten wird, das wurde leider nicht getestet, nur Bindung ohne Spaltung). Eine weitere gute Nachricht scheint mir, dass die nach der Impfung gebildeten Antikörper gegen das Spike, dieses nach der Bindung, zumindest in vitro an einer Bindung an ACE2 hindern. Ob IgG4 das auch tun sein mal dahingestellt, aber zumindest scheint die Immunität gegen das Impf-Spike soweit zu funktionieren, dass der Schaden durch Bindung an ACE2 zumindest in Schach gehalten wird.
Das könnte die Verschlimmerungen nach Booster erklären. Wenn IgG4 das Spike-Protein nicht mehr am Binden von ACE2 hindert anders als die Antikörper davor.
Omicron and Delta scheinen dabei starker an ACE2 zu binden als die Mu Variante. Leider gibt es keine Daten zum Wuhan-1/Alpha. Mu war eine späte Variante, die nach Omicron und Delta auftauchte (https://www.gelbe-liste.de/nachrichten/uebersicht-corona-varianten-mutanten), damit scheint es, dass die Bindung mit der Zeit wohl schwächer wird und das Virus weniger gefährlich. Ich habe mich aber ehrlicherweise nicht für die Varianten interessiert und sie auch nicht verfolgt.
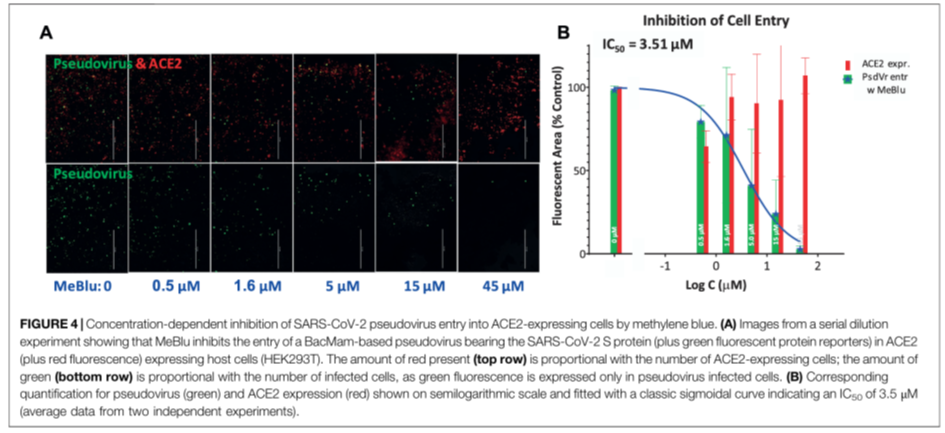
Ein einfaches Mittel, die Bindung des Spike-Proteins an ACE2 zu unterbinden (neben Curcurmin und Bromelain (https://pubmed.ncbi.nlm.nih.gov/38024037/)), scheint Methylenblau zu sein (https://pubmed.ncbi.nlm.nih.gov/33519460/), welches noch ein paar andere positive Effekte hat (Die molekularen, neuroprotektiven Mechanismen von Methylenblau (substack.com))
Nicht so gut wie Chloroquine, aber Methyleblau ist rezeptfei als Nahrungseränzungsmittel problemlos online zu bekommen und schon sehr früh Teil des FLCCC Protokolls. (https://covid19criticalcare.com/protocol/i-recover-post-vaccine-treatment/ und https://covid19criticalcare.com/tools-and-guides/low-dose-methylene-blue/)
Anti-ACE2 Antikörper
“Humane Angiotensin-Converting Enzyme 2 (ACE2) kreuzreaktive Anti-SARS-Coronavirus-2-Spike-Protein-Rezeptor-bindende Domäne (SARS-CoV-2 RBD) Antikörper (CR Abs) wurden als eine der Quellen von Anti-ACE2-Autoantikörpern berichtet.“ (https://pubmed.ncbi.nlm.nih.gov/38637878/)
Ein möglicher Schadmechanismus über ACE2 wäre also ein Autoimmunangriff auf Zellen, an deren ACE2-Rezeptoren anti-ACE2-Antikörper gebunden haben.
Grundlagen ACE/ACE2
Laut Pharma sieht die RAS-Kaskade so aus
(https://www.gelbe-liste.de/wirkstoffgruppen/ras-hemmer)
Zur Regulierung der Ras-Kaskade, gibt es verschiedene Wirkstoffgruppen:
1. „ACE-Hemmer: ACE-Hemmer blockieren die Bildung von Angiotensin II durch Hemmung der Konversion aus Angiotensin I. Außerdem wird durch sie der Abbau von Bradykinin verhindert, wodurch die vasodilatierenden und antiproliferativen Effekte von Bradykinin auf die Gefäße verlängert werden.“
2. AT1-Rezeptorantagonisten (Sartane): AT1-Rezeptorantagonisten (Sartane) blockieren selektiv den Angiotensin1-Rezeptor. Dadurch werden die Wirkungen von Angiontensin II verhindert. Zu den Sartanen zählen folgende Wirkstoffe:
3. Renininhibitoren hemmen die Bildung von Angiotensin I aus Angiotensinogen.
(https://www.gelbe-liste.de/wirkstoffgruppen/ras-hemmer)
Die Wirklichkeit scheint wieder einmal komplexer
Die Wirklichkeit scheint wieder einmal komplexer, als der Pharmareferent es einem erzählt hat. ACE hat auch noch Funktionen downstream von ACE2, wird also durch ein Binden des Spike-Proteins an ACE2 beeinflusst.
Bestandteile und Funktionen des Renin-Angiotensin-Systems (RAS). Angiotensinogen ist ein Plasmaprotein, das hauptsächlich in der Leber gebildet wird. Renin wird in juxtaglomerulären Zellen in den Nierenglomeruli synthetisiert und wandelt Angiotensinogen in Ang I um (1-10). Das Angiotensin Converting Enzyme (ACE), das sich auf den apikalen Membranen von Endothelzellen in verschiedenen Organen, insbesondere in der Lunge, befindet, katalysiert die Umwandlung von Ang I in den starken Vasokonstriktor Ang II (1-8). ACE2 ist auch eine Protease, die Ang I (1-10) in Ang-(1-9) und Ang II (1-8) in Ang-(1-7) umwandelt. Die Wirkung von Ang II auf die Zielzellen wird durch zwei Arten von Rezeptoren, AT1R und AT2R, vermittelt, die zu gegensätzlichen Wirkungen führen. Ang-(1-7) bindet auch an AT2R, und ein weiterer Rezeptor, der so genannte MAS-Rezeptor (Mitochondrial Assembly), hat positive Auswirkungen auf die Zielzellen.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10421715/figure/fig1/
Daher ist ACE2 wahrscheinlich an diversen, bisher noch (un-)bekannten pathophysiologischen Prozessen beteiligt (https://pathsocjournals.onlinelibrary.wiley.com/doi/10.1002/path.2162).
2007, im oben genannten Paper, waren bereits folgende Problemzonen bekannt:
1. „Das Wissen über die grundlegende Zellbiologie von ACE2 ist nach wie vor begrenzt, was zum Teil daran liegt, dass nur wenige Zellmodelle zur Verfügung stehen, die ACE2 in hoher Konzentration exprimieren.“
2. ACE2 und das Herz
3. ACE2 und Bluthochdruck
4. ACE2 und die Nieren
5. ACE2 und Lungenkrankheiten
6. ACE2 und Schwangerschaft (Hier gibt es auch noch neuere Daten (https://academic.oup.com/biolreprod/article/104/2/336/5987085)
7. ACE2 und Coronaviren
Und woran bindet das durch die modRNA vom Körper erzeugte Spike-Protein? ACE2!
Wo beobachten wir aktuell Probleme? Gibt es da vielleicht Überschneidungen? Klinge ich gerade ein wenig angefressen?
ACE2 und RAS sind aktuell das Steckenpferd von Jean-Marc Sabatier
(The Unsuspected Role of the Renin-Angiotensin System (RAS): Could its Dysregulation be at the Root of All Non-Genetic Human Diseases? - PubMed (nih.gov)) und hat darüber auch ein komplettes Buch (auf Französisch) geschrieben: https://www.amazon.de/dp/2813231185/
Wo aber im Körper findet man ACE2 Rezeptoren?
Proteinatlas
Der erste Schritt, um einen groben Überblick zu bekommen, wo ein Protein im Körper zu finden ist, ist der Proteinatlas (https://www.proteinatlas.org/).
Da kann man sich ACE2 aussuchen (https://www.proteinatlas.org/ENSG00000130234-ACE2/tissue).
Der Proteinatlas unterscheidet zwischen Mann und Frau (ist also noch nicht woke) und zwischen Expression, Detektion und allen Organen.
Expression
Expression (Frau/Mann)
Detektion
Alle Organe, die ACE2 exprimieren
Interaktionen von ACE2 mit anderen Proteinen (13)
Farblich sortiert danach wo in der Zelle die Proteine sind:
Farblich sortiert nach Proteinart
Die Störung von ACE2 kann also schon mal grob 13 andere Proteine deregulieren und die oben erwähnte RAS-Kaskade mit Ang 1-7 und ANG 1-9 scheint mir in dieser Übersicht zu fehlen.
Daher ist ACE2 wahrscheinlich an diversen, bisher noch (un-)bekannten pathophysiologischen Prozessen beteiligt (https://pathsocjournals.onlinelibrary.wiley.com/doi/10.1002/path.2162).
Ich schätze, der Proteinatlas greift auf die Daten wissenschaftlicher Paper zu und stellt sie als graphische Übersicht dar. Es gibt aber auch Einzelpublikationen, die einem einen Überblick verschaffen, nicht so schön, aber im Prinzip decken sich die Daten:
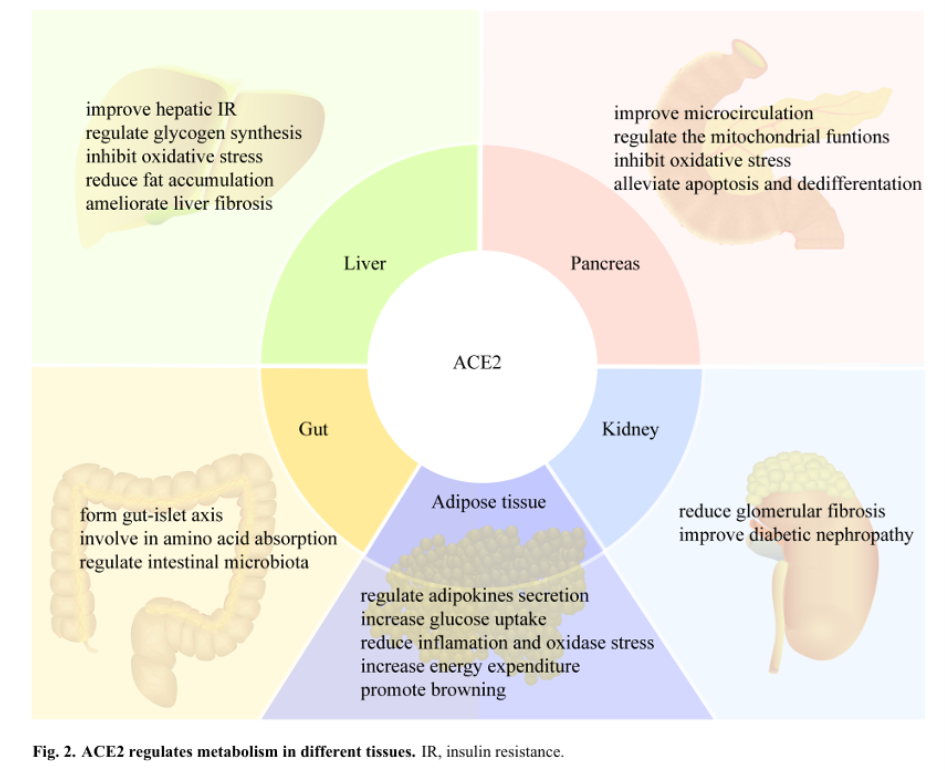
“ACE2 schützt eine Vielzahl von Organen und trägt zur physiologischen Stoffwechselhomöostase durch seine Enzym- und Aminosäuretransportfunktionen bei.”
https://pubmed.ncbi.nlm.nih.gov/38287822/
In allen Organen, die ACE2-Rezeptoren haben sind somit unbekannte toxische Effekte durch das Binden des Spike-Proteins oder Antikörper gegen ACE2 zu erwarten, wenn das nicht unterbunden wird.
Das Spike-Protein bindet an ACE2
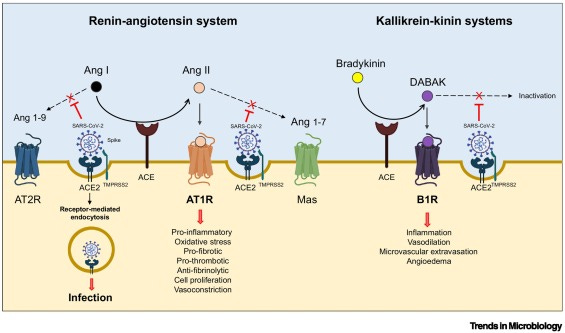
“Im Renin-Angiotensin-System katalysiert ACE die Umwandlung von Angiotensin (Ang) I in Ang II, ACE2 baut Ang II und Ang I zu Ang 1-7 bzw. Ang I zu Ang 1-9 ab. Im Kallikrein-Kinin-System wird Plasmabradykinin (BK) von ACE zu Des-Arg9-Bradykinin (DABAK) hydrolysiert, das anschließend von ACE2 in inaktive Peptide zerlegt wird. Das SARS-CoV-2-Virus heftet sich an ACE2 auf Endothelzellen durch direkte Bindung des Spike-Glykoproteins, das anschließend von der Transmembranprotease Serin 2 (TMPRSS2) gespalten und aktiviert wird, um die Fusion der Virus- und Zellmembranen einzuleiten. Während des Infektionsprozesses führt die rezeptorvermittelte Endozytose von ACE2, das an SARS-CoV-2 gebunden ist, zur Internalisierung des Virus und zur Infektion der Wirtszelle. Das Fehlen von ACE2 auf der Endothelzelloberfläche begünstigt die lokale Akkumulation von Ang II und DABK. Indem es auf seinen verwandten Rezeptor, den Angiotensinrezeptor Typ 1 (AT1R), wirkt, fördert Ang II letztlich einen proinflammatorischen und prothrombotischen Phänotyp, Ödeme und Entzündungen in Endothelzellen. Ein Mangel an ACE2 hemmt auch die Bildung von Ang 1-7 und Ang 1-9 und deren schützende, gefäßerweiternde, antifibrotische, antioxidative und antiproliferative Wirkung über den Mas-Rezeptor bzw. den Ang-Typ-II-Rezeptor (AT2R). Durch die Aktivierung des Bradykininrezeptors B1 (B1R) verursacht DABAK eine Entzündung, Vasodilatation, was zu einer erhöhten Gefäßpermeabilität und Flüssigkeitsextravasation führt.”
(SARS-CoV-2 and the spike protein in endotheliopathy - PubMed (nih.gov))
Was für das Virus gilt, gilt genauso für das Spike Protein.
Bradykinin kennt man vom Bradykinin-vermittelten Angioödem (Angioödem - Immunologie, Allergien - MSD Manual Profi-Ausgabe (msdmanuals.com)). Ich vermute mal, bei einigen waren die geschwollenen Augen und andere Schwellungen keine Allergie sondern teilweise ein Angioödoem, weil “Angiotensin-Converting-Enzym(ACE)-Hemmer können die Bradykinin-Spiegel direkt erhöhen.” Wenn da noch das Spike-Protein dazu kommt, könnte das Probleme bereiten.
Substanzen, die das Binden des Spike an ACE2 verhindern
Bromelain und Curcurmin (Clinical Approach to Post-acute Sequelae After COVID-19 Infection and Vaccination - PubMed (nih.gov))
Ivermectin (The mechanisms of action of ivermectin against SARS-CoV-2-an extensive review - PubMed (nih.gov), Ivermectin for COVID-19: real-time meta analysis of 103 studies (ivmmeta) (c19ivm.org))
Hydroxychloroquine (HCQ for COVID-19: real-time analysis of all 580 studies (c19hcq.org))
in vitro
Hydrangea macrophylla var. thunbergia (Dihydroisocoumarins of Hydrangea macrophylla var. thunbergia inhibit binding of the SARS-CoV-2 spike protein to ACE2 - PubMed (nih.gov))
Baicalin (Inhibitory Efficacy of Main Components of Scutellaria baicalensis on the Interaction between Spike Protein of SARS-CoV-2 and Human Angiotensin-Converting Enzyme II - PubMed (nih.gov), OSF Preprints | Therapeutic Properties of Baicalin - A Literature Review)
in silico Studien
Moringa (https://www.tandfonline.com/doi/figure/10.1080/07391102.2021.1898475)
Updates:
09.05.2024 Das Spike-Protein bindet an ACE2 (SARS-CoV-2 and the spike protein in endotheliopathy - PubMed (nih.gov))
11.05.2024 Substanzen, die das Binden des Spike an ACE2 verhindern
















Thanks very much Bine.
I have added your article as an update here:
https://geoffpain.substack.com/p/pfizer-used-synthetic-life-derived
Ein sehr schöne Übersicht.Ich erlaube mir etwas von mir mitzuteilen....,welches einige Aspekte näher beleuchtet
1. Spikeprotein ist per se toxisch über den ACE-2 Mechanismus
Josef M.Penninger, publizierte dies mit Fokus auf SARS-CoV1 2005 (Kuba et al. 2005) .Die kritische Rolle des Spikeproteins und der hiervon ausgelösten Signalkaskade (Ras-ERK-AP1) nach Bindung an ACE-2 konnte 2010 in der Zellkultur demonstriert werden (Chen et al. 2010).
2023 wurde von der Penninger Gruppe die Rolle von ACE-2 für die fatalen Konsequenzen der für Infektiosität optimierten Version SARS-CoV2 in einer Übersicht dargestellt (Oudit et al. 2023). Wichtig ist zur Beurteilung von Zellkultur- oder Tierexperimenten (z.B. in der Maus), dass zwar Omikron - aber nicht das Wuhan- Spikeprotein an Ratten oder Maus ACE-2-Rezeptoren bindet.
Versteckt in einer Abbildungsunterschrift findet man z.B.in (Schreckenberg et al. 2023) dass S1 nicht im Überstand der Ratten Myozyten Kultur wohl aber für die humane Herz-Zelllinie gefunden wurde. Die Autoren nahmen hierzu nicht Stellung.
Eine detaillierte Analyse der Ergebnisse von (Schreckenberg et al. 2023) findet sich im Kapitel 12 a.
Effekte auf Komplementsystem, Gerinnungsfaktoren, Hirnfunktion etc. sind bei Ratten und Mäusen daher über andere toxische Eigenschaften des Wuhan Spikeproteins zu erklären. Dies ist weitestgehend nicht der Fall, wenn sog. humanisierte Mausstämme verwendet werden.
2. Zellfusion und Freisetzung der S1 Untereinheit nach Injektion von BNT 162b2 (Pfizer- BioNTech oder mRNA-1273 (Moderna)
Eine wichtige Eigenschaft des Spikeproteins ist Zellfusion und die Bildung von Riesenzellen (Synzytien), begleitet von Freisetzung der (hydrophilen) S1 Einheit. (Clemens et al. 2023); (Theuerkauf et al. 2021) ;(Navaratnarajah et al. 2021); (Wan et al. 2023). (Siehe Kapitel 11). Die Freisetzung von S1 z.B. in der Zellkultur oder das Auftauchen von S1 im Plasma beim Menschen(Ogata et al. 2022) geschieht nur, wenn vorher eine Bindung an ACE-2 erfolgte. Eine Trennung von S1 und S2 via Furin (möglicherweise auch von anderen Proteasen) hat nämlich bereits im Golgi Kompartiment stattgefunden. Damit besteht der von der Zellmembran präsentierte Trimer aus 2 Komponenten, die im Anfangszustand „Präfusion“ und im Endzustand „Postfusion“ strukturell aufgeklärt wurden. Die hydrophobe S2 Untereinheit mit der transmembranösen (TM) Domäne und den „Lipid suchenden“ Fusions-Peptiden der S2 Untereinheit verbleibt folglich in der Donorzelle. Die Rolle der Glykosylierung und die mutmaßliche Abfolge der Ereignisse zwischen den Zuständen „Präfusion“ und „Postfusion“ werden in einem Video(Dodero-Rojas, Onuchic, and Whitford 2021) anschaulich dargestellt. Bei der „from without“ Fusion über EV verbleibt die S2 Untereinheit in der Membran der Vesikel, wie von (Bansal et al. 2021) für Pfizer-BioNTech gezeigt. Da das intakte Spikeprotein(S) in einem Vergleich von gesunden (adoleszenten) Probanden wesentlich vermehrt in Patienten mit Myokarditis im Plasma nachgewiesen wird (Yonker et al. 2023) ist aufgrund der Lipophilie von S der Einschluss in EVs (die nicht abgetrennt wurden!) höchst wahrscheinlich. Ob ggf. Lipoproteine eine ähnliche Funktion erfüllen können, ist denkbar aber bislang nicht untersucht. Die Arbeitsgruppe von Walt schrieb in (Swank et al. 2023): “We assume that spike will be incorporated in a membrane, …... extracellular vesicles, or remnants of dead …...cells. Given that we calibrate our assay with the spike ectodomain, which is missing the transmembrane domain, we cannot confirm that our S1 assay should bind spike in its natural conformation”. Mit anderen Worten: das Detektions -System war in der Arbeit von (Swank et al. 2023)nicht optimal, wurde aber in ( Yonker et al. 2023) mittels der Kombination von S1 und S2 spezifischen Antikörpern zuverlässig im Nachweis von S.