ModRNA- Sialinsäuren und das Spike-Protein
Low molecular Dextran als mögliche Behandlung?
Sialinsäuren
Laut Wikipedia sind Sialinsäuren: „Der Oberbegriff für die N- und O-substituierten Derivate der Neuraminsäure (Acylneuraminsäure). Häufig wird die im Menschen vorkommende N-Acetylneuraminsäure (NeuNAc oder NANA) als Sialinsäure bezeichnet. Der Begriff Sialinsäure umfasst aber auch eine Reihe weiterer Neuraminsäurederivate, auch wenn N-Acetylneuraminsäure die überwiegend vorkommende ist. […] N-Acetylneuraminsäure ist ein charakteristischer Bestandteil von Aminozuckern, die für Zell-Zell-Interaktionen von Bedeutung sind. Sialinsäure dient unter anderem dem Schutz der Proteine vor dem Abbau durch Proteasen.“ (https://de.wikipedia.org/wiki/Sialins%C3%A4uren)
Bild: N-Acetylneuraminsäure (https://de.wikipedia.org/wiki/Sialins%C3%A4uren#/media/Datei:N-Acetyl-neuramins%C3%A4ure.svg)
Sialinsäuren sind also kein Geheimnis, nichts geheimnisvolles, denn sie stehen sogar seit 25. Jan. 2004 bei Wikipedia. Kann mal also kennen, ist aktuell (noch) nicht zensiert und recht unpolitisch.
Ich habe bis vor diesem Artikel aber auch noch nicht von Sialinsäuren gehört, wusste nicht einmal dass es sie gibt und was sie tun war mir auch schleierhaft. Ich kann an dieser Stelle also niemandem Vorwürfe machen.
ABER, was nun kommt, hätte man als Wissenschaftler bei BioNTech, Moderna und Co wissen müssen. Es wäre ihr Job gewesen das zu wissen! Ihr Job, nicht meiner! Ich wollte diese Dinge nie wissen.
Warum sind Sialinsäuren im Kontext der modRNA Schäden wichtig?
Sialinsäuren im Kontext des Spike-Proteins sind wichtig, weil:
Alle Zellen Sialinsäuren auf der Oberfläche tragen (https://pubmed.ncbi.nlm.nih.gov/18606570/)
Das Spike-Protein erst an Sialinsäure bindet und dann erst auf ACE2 und andere Rezeptoren rüber rutscht (https://pubmed.ncbi.nlm.nih.gov/32047128/, https://pubmed.ncbi.nlm.nih.gov/38069362/). Sialinsäure ist ein Andockhilfe, die sehr viele Viren nutzen. Und im Juli 2020 gab es darauf bereits Hinweise (https://pubmed.ncbi.nlm.nih.gov/32658736/).
Oups!
Das Spike bindet an Sialinsäuren…
Das wusste man vor dem Start der „Impf-„Kampagne
Man hat das Problem geflissentlich 4 Jahre ignoriert!
Und das hat nun Konsequenzen.
Viren Binden an Sialinsäuren
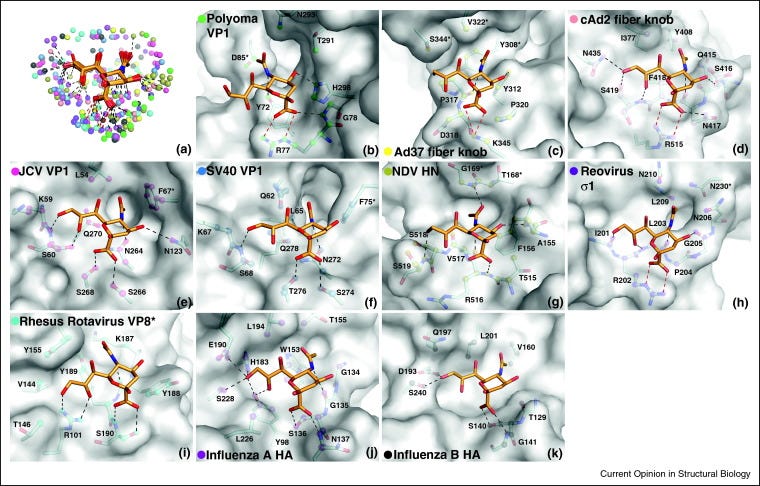
Dass Viren an Sialinsäuren binden ist biochemisch gut untersucht und für diverse Viren hübsch bebildert 2011 veröffentlicht worden. 9 Jahre vor der Plandemie.
Bild: Wechselwirkungen von viralen Anheftungsproteinen mit terminalem α-5-N-acetyl-neuraminic acid (Neu5Ac). (https://pubmed.ncbi.nlm.nih.gov/21917445/)
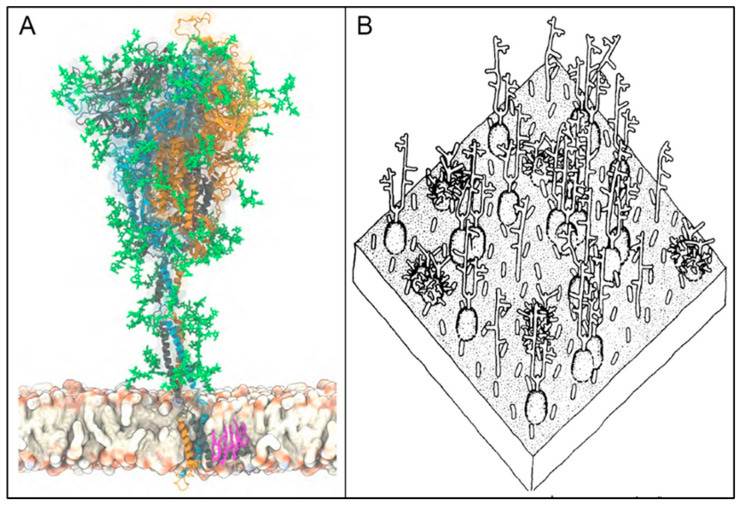
Dass das Spike Protein an Sialinsäuren bildet ist ebenfalls bestätigt und hübsch bebildert veröffentlicht:
(A): Atomistisches Modell des trimeren S-Proteins in voller Länge von SARS-CoV-2 in Cartoon-Darstellung, reproduziert aus Sikora et al. (2021). Die drei monomeren Ketten sind farblich unterschieden, wobei Glykane in grüner Lakritzdarstellung und ein palmitoylierter Cysteinrest in rosa dargestellt sind, der unten in der Virushülle verankert ist. (B): Darstellung eines 35 × 35 nm großen Bereichs der Erythrozytenoberfläche, der die Sialoglykoproteinbeschichtung zeigt (nach Viitala et al., 1975). Zu diesen sialylierten Glykanen gehören vor allem die GPA-Stränge, die sich etwa 5 nm von der Erythrozytenoberfläche erstrecken, und das Band 3-Protein, das sich > 10 nm von dieser Oberfläche erstreckt und durch Poly-N-Acetyllactosamin glykosyliert ist. Reproduziert (A) unter CC-BY 4.0 und (B) mit Genehmigung von Elsevier. (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10871123/)
Seit 1975 weiß man, das Erythrozyten Sialoglykoproteinbeschichtung haben (https://www.sciencedirect.com/science/article/abs/pii/0968000485900672?via%3Dihub). Im April 2021 wurde die detaillierte modellierte Bindung des Spike-Proteins an Sialinsäure publiziert (https://pubmed.ncbi.nlm.nih.gov/33793546/) und das Problem von den Herstellern weder thematisiert noch wurden irgendwelche Konsequenzen für die Plörre gezogen.
Man muss nur 1+1 zusammenzählen und zu dem Schluss kommen, dass das freie Spike-Protein, dass von transfizierten humanen Zellen produziert wird, sich an die Sialinsäure auf sämtlichen Zelloberflächen binden wird.
Diese Publikation (https://pubmed.ncbi.nlm.nih.gov/38069362/) fast belege dafür zusammen, dass das Spike-Protein selbst, die Erythrozyten verklumpt. Das ist somit keine Hypothese mehr, das ist gesichertes und ignoriertes Wissen.
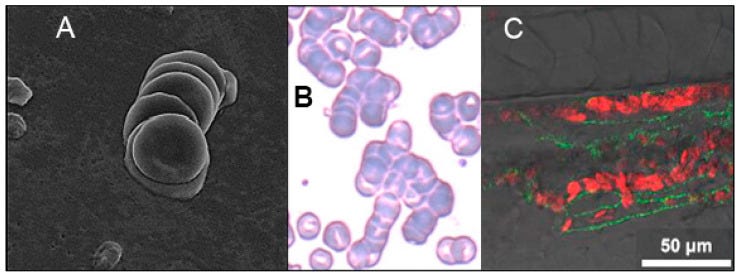
(A,B): Bilder von Erythrozyten-Klumpen (gestapelte Klumpen) aus dem Blut von COVID-19-Patienten, die mit Elektronen- (Vergrößerung ×5000) und Lichtmikroskopie (80× Objektiv) aufgenommen wurden. In der ersten Studie (A) wurden bei allen 31 untersuchten Patienten, die alle an einer leichten COVID-19-Erkrankung litten, Erythrozytenklumpen gefunden, und in der zweiten Studie (B) wurden bei 85 % der COVID-19-Patienten mit Anämie große Erythrozytenaggregate festgestellt. (C): Ein Bild aus einem Video von Erythrozytenaggregaten in Kapillaren von Zebrafischembryonen, die sich innerhalb von 3-5 Minuten nach Injektion von SARS-CoV-2 SP in die gemeinsame Kardinalvene in einer ähnlichen Konzentration wie bei schwerkranken COVID-19-Patienten bildeten. Die Geschwindigkeit des Blutflusses in den Kapillaren, die in diesem Videobild zu sehen ist, war deutlich geringer als vor der Injektion von SP.
ALSO man hat beobachtet, dass Erytrozyten von Menschen mit SARS-CoV-2 Infektion verklumpen und hat beim Zebrafisch mal geschaut, ob das vielleicht am Spike-Protein alleine liegen könnte. Das Fischblut brachte den Beleg, dass es das Spike selbstpersönlich war, welches das Blut verklumpen ließ.
„In Studien an Mäusen (https://academic.oup.com/cid/article/74/11/1933/6353927) und Ratten (https://besps.journals.ekb.eg/article_306698.html) umfasste das Spektrum der unerwünschten Wirkungen, die durch die intravenöse Injektion des BNT162b2-Impfstoffs verursacht wurden (im Gegensatz zur intramuskulären (IM) Verabreichung, die klinisch verwendet wird), eine ausgeprägte Hyperkoagulabilität des Blutes zusammen mit Herzbeutelschäden, Veränderungen des Elektrokardiogramms und anderen Anomalien, die eine Schädigung des Herzmuskels widerspiegeln. Ähnliche Myokardverletzungen waren häufige unerwünschte Wirkungen in den Studien zur Verklumpung von Erythrozyten mit hochmolekularen Bestandteilen. Alle Mäuse in den IV- und IM-injizierten Gruppen der mRNA-Injektionsstudie an Mäusen wiesen eine myokardiale WBC-Infiltration sowie eine Degeneration und Nekrose der Kardiomyozyten auf, während es bei den mit Kochsalzlösung injizierten Kontrollen keine Auswirkungen gab.“ (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Den Versuchstieren wurde übrigens das menschliche mod-RNA-Produkt gespritzt, wie schon der Titel der Publikationen klar belegt:
COVID 19 m-RNA (Pfizer) vaccination impairs cardiac functions in adult male rats (ekb.eg)
Klingt für mich irgendwie, als wenn diese Tierversuche den Aussagen und Daten der Tierversuche von BioNTech/Pfizer widersprechen. Liegt vielleicht daran, dass in den Tierversuchen eine ganz spezielel Charge ohne dsRNA Verunreinigung verwendet wurde?
Spike-Proteine binden an sialynisierte Glycane auf den Oberflächen von Eukaryotischen Zellen.
Die Menschen, die „geimpf“ wurden produzieren Spike-Proteine.
Die Menschen, die „geimpft“ wurden, haben dickeres Blut (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8216419/, https://pubmed.ncbi.nlm.nih.gov/35608715/.
Dickeres, zäheres Blut führt zu Thrombosen.
ABER
Alle Zellen haben sialynisierte Glycane auf den Oberflächen…
Das Spike-Protein kann somit an alle Zellen binden, die sialynisierte Glycane auf den Oberflächen haben, nicht nur Blutzellen.
„In Übereinstimmung mit der seit Jahrzehnten bekannten Biochemie von Coronaviren erfolgt die erste Anheftung von SARS-CoV-2 an Wirtszellen durch die Bindung seines Spike-Proteins (SP) an sialylierte Glykane (die das Monosaccharid Sialinsäure enthalten) auf der Zelloberfläche. Das Virus kann dann darüber gleiten und über ACE2 eindringen.“ (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Das heißt somit, dass selbst in Zellen mit wenig ACE2 auf der Oberfläche, wegen der Sialynisierten Glycanen selbst bei diesen Zellen RAS aktiviert wird. Darunter fallen z. Bsp. die Immunzellen…
Deregulation von praktisch allem über RAS und AT1R
Disclaimer und Spoiler: Es mag nach diesem Artikel vielleicht so klingen, dass die RAS-Kaskade die Ursache für alle Nebenwirkungen sein könnte. ABER VORSICHT! Der Körper hat N Möglichkeiten sich zu äußern. Diesen Symptomen können aber X verschiedene Ursachen zugrunde liegen.
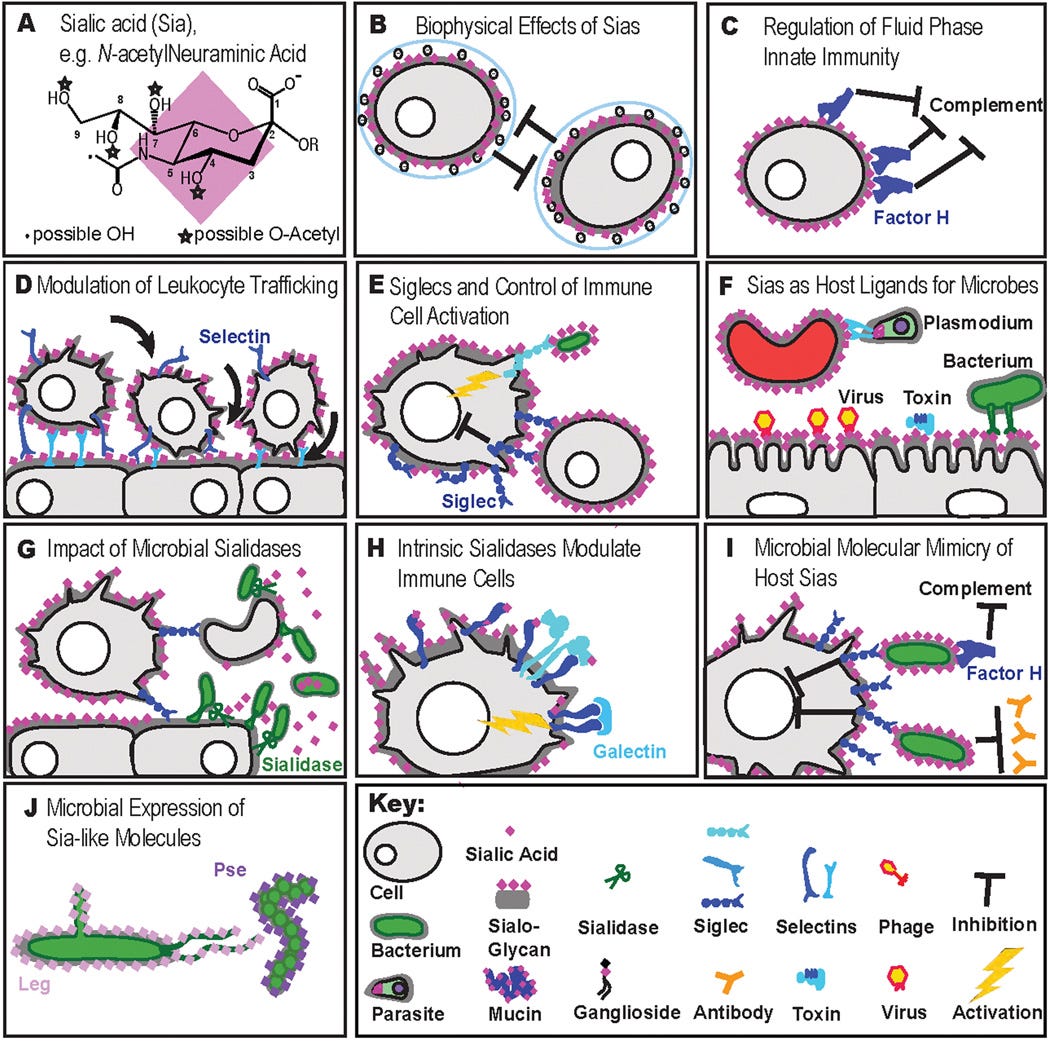
Sialinsäure und das Immunsystem
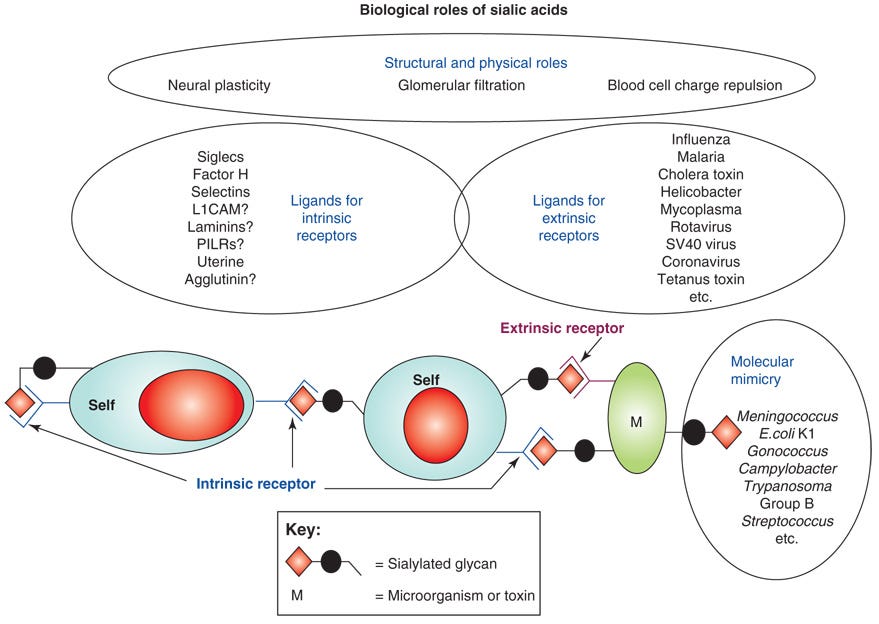
„Einige biologische und pathologische Funktionen von Sialinsäuren.
1. haben Sialinsäuren aufgrund ihrer negativen Ladung und Hydrophilie viele strukturelle oder physikalische Funktionen, z. B. bei der neuronalen Plastizität, der glomerulären Filtration oder der Abstoßung von Blutzellladungen.
2. dienen Sialinsäuren als Bestandteile von Bindungsstellen für verschiedene Krankheitserreger und Toxine. Bei den meisten dieser Interaktionen erkennt ein pathogenbindendes Protein (extrinsischer Rezeptor) bestimmte Formen von Sialinsäuren, die in spezifischen Verknüpfungen mit einer definierten zugrunde liegenden Zuckerkette vorliegen.
3. dienen Sialinsäuren als Liganden für intrinsische Rezeptoren wie Siglecs und Faktor H. Die möglichen Wechselwirkungen zwischen Sialinsäuren (als sialylierte Glykanmoleküle), die auf Wirtszellen (selbst) exprimiert werden, und intrinsischen Rezeptoren, die auf denselben oder anderen Wirtszellen exprimiert werden, werden dargestellt. Eine letzte Klasse von Funktionen ist die "molekulare Mimikry", bei der sich erfolgreiche mikrobielle Krankheitserreger mit Sialinsäuren schmücken und so der Wirtsimmunität entgehen. Diese verschiedenen Funktionen von Sialinsäuren sind bis zu einem gewissen Grad antagonistisch und führen zu einem evolutionären Wettrüsten, bei dem Wirbeltierwirte Sialinsäuren für kritische endogene Funktionen aufrechterhalten müssen - auch wenn sie diese ständig verändern, um sich schnell entwickelnden Pathogenen zu entgehen, die sich entweder an sie binden oder sie nachahmen.
Abkürzungen: L1CAM, L1-Zelladhäsionsmolekül; PILR, gepaarter immunglobulinähnlicher Rezeptor.“ (https://pubmed.ncbi.nlm.nih.gov/18606570/)
Beispiele für die Rolle der Sialinsäuren in der Immunität. Sialinsäuren sind als rosa Rauten dargestellt. Einzelheiten sind dem Text zu entnehmen.
(A) terminalem α-5-N-acetyl-neuraminic acid (Neu5Ac), die bei Säugetieren am häufigsten vorkommende Sialinsäure. Diese sauren Zucker haben ein 9-Kohlenstoff-Grundgerüst und können auf vielfältige Weise modifiziert werden.
(B) Die hohe Dichte terminaler Sialinsäuren auf der Glykokalyx (Anmerkung: Schicht an der Außenfläche der Zellmembran) von Wirbeltierzellen verleiht der Zelloberfläche eine negative Ladung und Hydrophilie, was die biophysikalischen Eigenschaften verändert.
(C) Faktor H bindet Sialinsäuren an der Zelloberfläche und schützt die Zelloberfläche vor dem alternativen Komplementweg.
(D) Intrinsische Sialinsäure-bindende Moleküle wie Selektine auf Endothelien, Leukozyten und Thrombozyten initiieren das Rollen von Leukozyten auf Endotheloberflächen, ein wichtiger erster Schritt für die Extravasation von Leukozyten.
(E) Intrinsische Sialinsäure-bindende Siglec-Moleküle auf Immunzellen erkennen sialylierte Liganden und können die Aktivierung von Immunzellen hemmen. (Anmerkung: (Siglec=Sialic acid-binding immunoglobulin-type lectins) Sialinsäure-bindende Lektine vom Immunglobulin-Typ) sind Zelloberflächenproteine, die Sialinsäure binden (https://en.wikipedia.org/wiki/Siglec)). Es gibt auch aktivierende Siglecs.
(F) Wirts-Sialynsäuren werden häufig von Krankheitserregern wie Protozoen, Viren, Bakterien und Toxinen als Anheftungsstellen ("Rezeptoren") genutzt.
(G) Mikrobielle Sialidasen können Pathogenen helfen, darunter liegende Glykanbindungsstellen freizulegen, sialylierte Köder (siehe unten) zu vermeiden und/oder Sias als Nahrungsquellen bereitzustellen. Der Verlust von SAMPs aus Zellen kann dann von Immunzellen des Wirts genutzt werden, um auf Pathogene zu reagieren und/oder um desialylierte Zellen oder Glykoproteine zu entfernen.
(H) Endogene Sialidasen wie Neu1 können die Funktion von Immunzellen modulieren, indem sie das Clustering von Rezeptoren beeinflussen, möglicherweise durch Freilegung der darunter liegenden Galaktosereste und Erleichterung der durch Galektin vermittelten Vernetzung von Oberflächenmolekülen.
(I) Die mikrobielle Nachahmung von Wirts-Sialynsäuren ermöglicht die Beeinflussung der Immunantwort des Wirts, indem sie hemmende Siglecs aktiviert, das Komplement über die Bindung von Faktor H hemmt und die Möglichkeit des Wirts, Antikörper zu bilden, verringert.
(J) Die mikrobielle Synthese von Sia-ähnlichen Molekülen, wie Legionamin- und Pseudaminsäure, stabilisiert Fimbrien. (https://pubmed.ncbi.nlm.nih.gov/18606570/)
Könnte es sein, dass das Spike-Protein wie ein Siglec wirkt und so die Hemmung der Immunantwort bewirkt? Zusätzlich Aktivierung des internen RAS der Immunzellen und diese somit komplett biochemisch dereguliert?
Diagnose
Die Wirkung des SARS-CoV-2-Virus und des SARS-CoV-2-Spike-Proteins auf sialynisierte Glycane sind gleichzusetzen, da das SARS-CoV-2-Virus über das Spike-Protein an sialynisierte Glycane bindet. Das sialynisierte Glycan unterscheidet nicht, ob am Spike-Protein noch ein Virus dran hängt oder nicht. Schlüssel-Schloss-Prinzip, Mittelstufenschulstoff. Das Spike-Protein bindet an sialynisierte Glycane, egal ob es Teil des Virus ist oder nicht.
Die Diagnosekriterien beziehen sich im zitierten Paper auf das Virus und nicht das Spike-Protein allein, könnten aber auch für das Spike-Protein selbst gelten.
Spike-Protein "induzierte Verklumpung der Erythrozyten spiegelt sich in einer signifikant erhöhten Erythrozyten-Sedimentationsrate (ESR) und verringerten Hämatokritwerten wider [...] der von Willebrand-Faktor (vWF), ein Mediator der Immunthrombose in Verbindung mit endothelialer Entzündung, ist [...] erhöht [...]." (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Behandlung
„Die Verklumpung von Erythrozyten, die experimentell bei mehreren Tierarten durch Injektion des Polysaccharids HMWD ausgelöst wurde, verursachte die meisten der gleichen Erkrankungen wie bei schwerem COVID-19, insbesondere mikrovaskuläre Verschlüsse, Hypoxie und Blutgerinnsel. In Studien, die bis in die 1940er Jahre zurückreichen, wurde bei Hunden, Kaninchen, Mäusen, Hamstern und anderen Tieren innerhalb von Minuten bis Stunden nach der Injektion von HMWD eine Verklumpung der Erythrozyten ausgelöst, gefolgt von den festgestellten Morbiditäten, wobei die molekulare Überbrückung der Erythrozyten durch HMWD ein vermuteter Mechanismus ist. Niedermolekulares Dextran (LMWD) hemmte diese Verklumpung der Erythrozyten und den mikrovaskulären Verschluss, wenn die Verklumpung der Erythrozyten noch nicht zur Gerinnung fortgeschritten war.“ (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Wie praktisch, dass Pfizer das auch direkt im Sortiment hat (https://www.pfizer.com/products/product-detail/low_molecular_weight_dextran)
FischerScientific hat es auch in USP Qualität https://www.fishersci.com/shop/products/dextran-40-powder-usp-spectrum-chemical-1/18602075
Wäre soger nicht einmal off-label use „Spectrum™ Chemical Dextran 40, Pulver, USP wird als Antithrombotikum verwendet, um die Blutviskosität zu verringern.“
ABER VORSICHT!
„Eine wichtige Erkenntnis im Zusammenhang mit der experimentell induzierten Verklumpung von Erythrozyten durch HMWD und deren Hemmung und Umkehrung durch LMWD ist, dass die Verklumpung von Erythrozyten selbst bei gesunden Säugetieren unter den Bedingungen eines langsamen Blutflusses vorübergehend auftritt, wobei größere Klumpen über ein verteiltes Netz von Arteriolen und eine pulmonale Catch-trap-Architektur sequestriert werden. Wenn das Ausmaß der Verklumpung der Erythrozyten die Kapazität dieses Sequestrierungsnetzes übersteigt oder wenn sich fibrinstabilisierte Mikrothromben bilden, ist dies jedoch nicht mehr ohne weiteres reversibel, und die in diesen Studien beobachteten Morbiditäten treten auf.“ (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Die seltsamen Hirschman-Clots
https://x.com/r_hirschman/status/1800562643888931174
Kovalente glykosidische Bindungen von Sialinsäure zu anderen Zuckermonomeren können auch Glykane, die die 22 N-Glykosylierungsstellen und die vier O-Glykosylierungsstellen von SARS-CoV-2 besiedeln, mit ineinandergreifenden Glykanen auf Wirtszellen verbinden (https://pubmed.ncbi.nlm.nih.gov/38675987/).
Ist das vielleicht eine der Ursachen für diese seltsamen Clots, welche die Einbalsamierer aus den Gefäßen ziehen?
Spike-Protein gebunden an sialynisierte Glycane, die sich vernetzen zusätzlich zu einer möglichen Vernetzung der trimeren Spike-Proteine untereinander zu Hexameren und Nonameren?
(https://pubmed.ncbi.nlm.nih.gov/33082295/)
Fazit
„Obwohl weitere zelluläre Rezeptoren, darunter Neuropilin-1 und der nikotinische Alpha-7-Acetylcholinrezeptor, für bestimmte Zelltypen wahrscheinliche Ziele von SARS-CoV-2 sind, ist Silalinsäure von vorrangigem Interesse, da es, wie bereits erwähnt, für dieses und andere Coronaviren als erster Anheftungspunkt auf allen Wirtszellen dient und auf eukaryotischen Zelloberflächen ubiquitär ist. Obwohl die Anheftung von SARS-CoV-2 SP an sialylierte Wirtszellglykane in mehreren Studien nachgewiesen wurde, steht ein vollständiges Verständnis darüber, wie verschiedene chemische Bindungen diese Anheftung unterstützen, noch aus. Am auffälligsten ist die Anziehung zwischen den positiv geladenen SARS-CoV-2 Spike-Protein und den negativ geladenen, dicht verteilten Sialinsäure auf den Oberflächen von Erythrozyten, Thrombozyten und Endothelzellen […].“ (https://pubmed.ncbi.nlm.nih.gov/38675987/)
Die Firmen wussten, dass das Spike-Protein an Sialinsäure bindet.
Sie haben es ignoriert und das Spike als „harmlos“ tituliert.
Das P-Lock hätte, selbst wenn es funktioniert hätte, die Bindung an Sialinsäure NICHT verhindert.
Das P-Lock war Ablenkung and Augenwischerei.
Werden Zellen, an welche das Spike-Protein über SIA gebunden hat noch von Antikörpern erkannt? Wenn ja, was passiert mit Zellen, die mit Antikörpern dekoriertes Spike Protein an ihrer Oberfläche haben? Werden sie nur von außen geputzt oder zerstört?
Das Ziel war möglicherweise von Anfang an die Bindung des freien Spike-Proteins an Sialinsäure, daher hat man das Thema totgeschwiegen und nie aufgegriffen.
Das kann ich leider nicht beweisen, das ist alles nur böse Verschwörungstheorie.
Obwohl…
Omicron bindet besser an Sialinsäure und hat eine stärkere hämagglutinierende Wirkung (https://pubmed.ncbi.nlm.nih.gov/38675987/), das ist aber sicherlich nur Zufall, wie so vieles im Zusammenhang mit der Plandemie.








Yes, glycosolation is HUGE. NO assessment of glycan binding sites were ever provided. Supposedly, for that famous western blot, Pfizer said the size was bigger because of glycosolation, but smarter people than I said the WB was bigger than if every site was occupied by a sugar.
Spike protein is not very toxic unless it is glycosolated or has endotoxin on it
https://link.springer.com/article/10.1007/s10565-021-09693-y
Also, that is why I am on berberine. Everyone needs to be eating a ketogenic type diet and be taking metformin or berberine.
Thanks! This circles us back to the S1-NTD-Gal3-IgG4 axis. Neuropathology is another risk, and you will see amyloid beta aggregation discussed:
Sialylation and Galectin-3 in Microglia-Mediated Neuroinflammation and Neurodegeneration
"... Activated microglia also release galectin-3 (Gal-3), which: (i) further activates microglia via binding to TLR4 and TREM2, (ii) binds to desialylated neurons opsonizing them for phagocytosis via Mer tyrosine kinase, and (iii) promotes Aβ aggregation and toxicity in vivo. Gal-3 and desialylation may increase in a variety of brain pathologies. Thus, Gal-3 and sialidases are potential treatment targets to prevent neuroinflammation and neurodegeneration."
https://pubmed.ncbi.nlm.nih.gov/32581723/