Fotoinaktivierung von RNA-Viren mit Methylenblau
Antiviral Res. 2004 Mar;61(3):141-51. doi: 10.1016/j.antiviral.2003.11.004.
Dass Methylenblau besser mit Licht als ohne Licht funktioniert hat man schon sehr früh bei Krebsbehandlungen mit Methylenblau festgestellt. Auch, dass man Viren mit Methylenblau inaktivieren kann, war vor dem ersten Weltkrieg bereits bekannt.1
Die Nutzer von Methylenblau ignorieren meistens, dass es sich bei Methylenblau und eine fotoaktive, fluoreszierende Substanz handelt, welche mit Licht besser funktioniert als ohne und die eben auch Licht abgibt, was heutzutage komplett ignoriert wird.
Es gibt einen Übersichtsartikel aus dem Jahr 2004, der die modernen fotoaktiven Mechanismen von Methylenblau zusammenfasst.
Floyd RA, Schneider JE Jr, Dittmer DP. Methylene blue photoinactivation of RNA viruses. Antiviral Res. 2004 Mar;61(3):141-51. doi: 10.1016/j.antiviral.2003.11.004. PMID: 15168794. https://pubmed.ncbi.nlm.nih.gov/15168794/
Ich übersetze hier nur die Highlights aus dem Artikel. Wer es genau wissen will, soll das Original lesen.
Abstract
“Wir präsentieren einen Überblick über den aktuellen Stand der Verwendung von Methylenblau (MB) zur Photoinaktivierung von Viren, beginnend mit den ersten frühen Beobachtungen bis hin zu seiner aktuellen Verwendung zur Inaktivierung von HIV-1 in Blutprodukten. Grundlegende Wirkmechanismusstudien mit Modellbakteriophagen deuten darauf hin, dass die MB-photomediierte virale RNA-Protein-Vernetzung eine primäre Läsion ist und dass Sauerstoff, insbesondere Singulett-Sauerstoff, ebenfalls eine sehr wichtige Rolle spielt. Grundlegende Studien zum Wirkmechanismus bei HIV fehlen; wir zeigen jedoch neue Daten, die belegen, dass die Inaktivierung der viralen reversen Transkriptase allein nicht für die MB-vermittelte Photoinaktivierung verantwortlich ist. Wir zeigen auch Daten, die belegen, dass MB die Inaktivierung des West-Nil-Virus, eines Flavivirus, photomediiert, das eine bedeutende neue Bedrohung für die kontinentalen Vereinigten Staaten darstellt. Die MB-Photoinaktivierung von Viren ist vielversprechend, da diese Technologie nicht nur eine hohe Wirksamkeit aufweist, sondern auch aufgrund der langjährigen sicheren Anwendung von MB in der Humanmedizin attraktiv ist.”2
Einleitung
“MB in Gegenwart von Licht inaktiviert RNA-Viren wirksam. Diese Technologie wird derzeit in einigen Blutbanken in Europa eingesetzt, um HIV-1 in Blut und Blutprodukten zu inaktivieren. Neben der Wirksamkeit dieser Technologie bei der Virusinaktivierung ist die Tatsache, dass MB seit vielen Jahren in verschiedenen Behandlungen am Menschen eingesetzt wird, ein weiterer attraktiver Aspekt.”
Sehr frühe Beobachtungen zur antiviralen Wirkung von MB
“Die ersten Beobachtungen zur Fähigkeit von MB, Bakteriophagen und Viren zu inaktivieren, wurden in den frühen 1930er Jahren gemacht”.3
“Es wurde festgestellt, dass sowohl Licht als auch Sauerstoff für die MB-vermittelte Virusinaktivierung wichtig sind. Darüber hinaus wurden Daten zur Wirksamkeit von MB und direktem Sonnenlicht bei der In-vivo-Hemmung von Virusinfektionen bei kürzlich (12–18 Stunden) infizierten Tieren mit Haut- oder Augenläsionen vorgelegt4. Eine Übersicht über die Inaktivierung von Tierviren durch Licht wurde von Wallis und Melnick (1965) vorgelegt.5 Diese Übersicht aus dem Jahr 1965 zeigte, dass seit den 1930er Jahren nur sehr wenige Fortschritte erzielt worden waren, abgesehen davon, dass quantitativere Methoden zur Virusinaktivierung und -charakterisierung verwendet wurden und dass Toluidinblau, ein chemisches Analogon von MB, als wirksam beschrieben wurde. Die meisten der genannten Forschungsarbeiten wurden jedoch mit Proflavin als Photosensibilisator durchgeführt. Die Beobachtungen von Heinmets et al. (1955)6 zur Verwendung von MB zur Inaktivierung verschiedener Viren in menschlichem Blutplasma wurden nicht berücksichtigt, da diese vom Militär unterstützten Studien nach ihrer Durchführung über 30 Jahre lang nicht öffentlich zugänglich waren.”
Streng genommen gab es auch noch diverse andere Studien mit Methylenblau (und blauem Licht), die in diesem Review nicht zitiert werden, die zum Teil bereits 1904 statt fanden. Diese sind aber meist in Deutsch veröffentlicht und nicht in wissenschaftlichen Datenbanken hinterlegt.
Methylenblau in Kombination mit Lichttherapie
“Die Bedeutung von Methylenblau (MB) in der photodynamischen Therapie gegen Mikroben ist gut etabliert..”
MB-Grundlagen der Photochemie
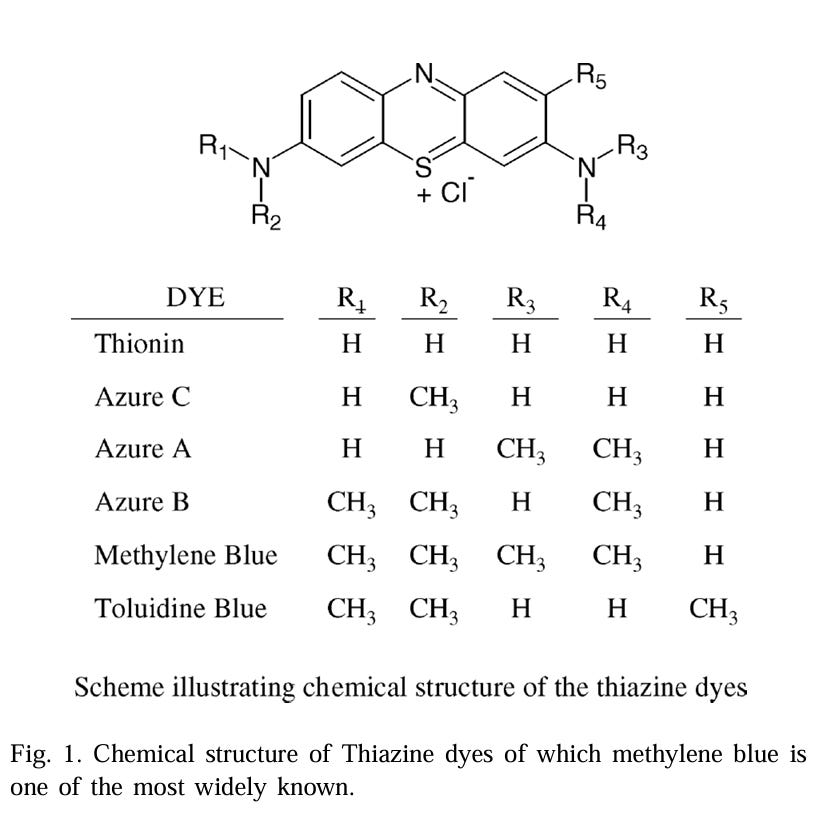
“MB wird üblicherweise als Thiazin-Farbstoff klassifiziert, seine formale chemische Bezeichnung lautet jedoch 3,7-Bis(dimethylamino)phenothiazin-5-iumchlorid. Seine Struktur ist in Abb. 1 dargestellt. Ebenfalls dargestellt ist die Formel für die häufiger erhältlichen Thiazin-Farbstoffanaloga. Es sind natürlich viele andere chemische Derivate möglich, und tatsächlich wurden auch andere auf ihre antivirale Wirkung untersucht”
“Schema zur Veranschaulichung der grundlegenden Photochemie von Methylenblau (MB). MB wird durch Licht in den angeregten Singulettzustand (1MB) aktiviert. 1MB kann mit im Wesentlichen gleicher Wahrscheinlichkeit entweder in den Grundzustand oder in den angeregten Triplettzustand 3MB zerfallen. 3MB kann in Typ-II-vermittelten Prozessen mit Sauerstoff zu Singulett-Sauerstoff (1O2) und MB im Grundzustand reagieren oder alternativ in einem viel langsameren Prozess zu Superoxid und MB. Alternativ kann 3MB auch in Typ-I-Prozessen reagieren, bei denen Wasserstoffatom- oder Elektronentransferprozesse mit Lösungsmittel oder gelöstem Stoff stattfinden können.”
“Licht regt MB im Grundzustand in einen angeregten Singulettzustand (1MB) an, der (basierend auf der Reaktionsgeschwindigkeit) mit etwa gleicher Wahrscheinlichkeit in den Grundzustand oder in einen angeregten Triplettzustand (3MB) zurückkehrt. Der angeregte Triplettzustand MB kann sehr langsam in den Grundzustand zurückfallen oder durch Typ-I- oder Typ-II-Reaktionen reagieren. Typ-II-Reaktionen finden in Gegenwart von Sauerstoff statt. Die schnellste Typ-II-Reaktion ist die Reaktion mit Sauerstoff unter Bildung von Singulett-Sauerstoff und MB im Grundzustand. Es ist zu beachten, dass dies eine quantenmechanisch zulässige Reaktion ist, da Sauerstoff in seinem Grundzustand als Triplett-Molekül vorliegt. Singulett-Sauerstoff hat einen um 23 kcal höheren Energiezustand als Sauerstoff im Grundzustand und ist ein sehr starkes Oxidationsmittel. Angeregter MB im Triplettzustand kann auch mit Sauerstoff reagieren und Superoxid bilden, dessen Bildung jedoch viel langsamer erfolgt als die von Singulett-Sauerstoff. Angeregter MB im Triplettzustand kann auch mit Substrat oder Lösungsmittel reagieren und in Typ-I-Reaktionen den Transfer von H-Atomen oder Elektronen vermitteln. Typ-I-Reaktionen können in luftgesättigten wässrigen Lösungen auftreten7. Foote präsentiert Daten, die zeigen, dass Typ-I- und Typ-II-Reaktionen von 3MB in den Reaktionen mit Guanosinmonophosphat in O2-gesättigten organischen Lösungsmitteln oder luftgesättigten wässrigen Lösungen etwa gleich wichtig sind.8”
Letztendlich ist es aber so, dass man eigentlich immer noch nicht wirklich weiß, wie Methylenblau in diesem Fall wirklich funktioniert. Hinweise könnten die alten Experimente geben, die ich oben verlinkt habe. Die Farbe also die (Licht-)Frequenz scheint auch einen Effekt zu haben, den man beobachtet hat, aber bis heute nicht versteht.9
Es ist klar, dass es viele mechanistische Unbekannte gibt, die für die antivirale Wirkung von MB verantwortlich sind. Es ist durchaus möglich, dass sequenzielle Reaktionen beteiligt sind: zunächst photochemische Ereignisse, die unabhängig von Sauerstoff ablaufen, gefolgt von solchen, an denen Singulett-Sauerstoff beteiligt ist.
Auch wenn man nicht weiß, wie Methylenblau wirklich gegen Viren funktioniert, gibt es doch einige Hinweise auf mögliche Wirkmechanismen.
MB-photomediierte virale RNA-Protein-Vernetzung
“Unsere Ergebnisse zeigen eindeutig, dass die Photomediierung der viralen RNA-Protein-Vernetzung wahrscheinlich der wichtigste Vorgang bei der Virusinaktivierung ist. Die wichtigsten Ergebnisse sind in Abb. 3 zusammengefasst. Diese Ergebnisse zeigen, dass die Bestrahlung von Q-Phagen in Gegenwart steigender MB-Konzentrationen zu einer exponentiell ansteigenden Menge an viralen RNA-Protein-Vernetzungsprodukten führte.”
“Daten, die zeigen, dass Qbeta bei Beleuchtung mit weißem Licht in Gegenwart von Sauerstoff die Vermittlung von viralen RNA-Protein-Quervernetzungen bewirkt. Wässrige RNA steht für die mit Phenol extrahierbare RNA. Die kombinierte RNA ist die Summe der in der wässrigen Fraktion vorhandenen RNA und der in der Grenzflächenfraktion vorhandenen RNA, d. h. der RNA-Protein-Quervernetzungen. Ebenfalls dargestellt ist die Menge an 8-OHG im Verhältnis zu den letalen Treffern. Die dargestellten Daten sind aus unserer veröffentlichten Studie10 zusammengefasst.”
Lichtspektraluntersuchungen in MB-photomediierter Aktivität
“Theoretisch wird erwartet, dass die effektivste Wellenlänge für MB-photomedierte Prozesse bei 665 nm liegt, dies wurde jedoch nicht eindeutig nachgewiesen.”
660 nm wäre eine ganz normale Rotlichtlampe.
Den 660 nm widersprechen aber die alten Beobachtungen, dass MB bei Krebs besser funktioniert, wenn Licht an die betroffene Stelle kommt. Wäre Wärme ausreichend gewesen, wäre Kleidung über der entsprechenden Stelle kein Problem gewesen. Es müssten also auch sichtbare Frequenzen und/oder UV und nicht nur Infrarot eine Rolle spielen.11
Verwendung von MB zur Photoinaktivierung von HIV in Blutprodukten
“Die MB-Photoinaktivierungstechnologie wird derzeit in einigen europäischen Blutbanken zur Inaktivierung von HIV in Blutprodukten eingesetzt. Dies ist vor allem auf die frühen Arbeiten der Gruppe um Mohr zurückzuführen, die das Potenzial von Phe-Nothiazinfarbstoffen zur Photoinaktivierung mehrerer Modellviren sowie von HIV-1 in frisch gefrorenem menschlichem Plasma nachgewiesen haben12. Innerhalb eines Jahres nach dieser Veröffentlichung wurden beispielsweise zwischen Februar und Oktober 1992 in Niedersachsen (BRD) über 40.000 Einheiten behandeltes Plasma verwendet13. Die seitdem durchgeführten Folgeuntersuchungen und Weiterentwicklungen wurden in mehreren Kurzberichten der Mohr-Gruppe zusammengefasst14 15 16 17. Wagner hat diesen Bereich kürzlich in einem breiteren, allgemeineren Kontext untersucht, in dem auch das Potenzial anderer Phenothiazinfarbstoffe, darunter Dimethylmethylene Blue, diskutiert wurde18.”
“Abb. 4: Wirkung von MB auf die HIV-Inaktivierung in Vollblut (WB), plättchenreichem Plasma (PRP), Blutplasma und DMEM-Medien. Etwa 3 × 105 aktive HIV-Virionen/ml wurden zu jedem dieser Medien hinzugefügt und nach etwa 15-minütiger Inkubation unter leichtem Schütteln wurde eine Aliquote entnommen, um die aktiven Virionen zu bestimmen. Zu anderen Fraktionen des beimpften Mediums wurde MB in einer Endkonzentration von 1 oder 5 M hinzugefügt. Das mit MB behandelte beimpfte Medium wurde 15 Minuten lang im Dunkeln inkubiert, dann bis zu einer Tiefe von 0,5 cm in Petrischalen mit einem Durchmesser von 4 cm gegeben und 30 Minuten lang bei Raumtemperatur mit einem 100-W-Weichlichtstrahler (Sylvania Tungsram 7) belichtet. Um die infraroten (wärmeerzeugenden) Strahlen zu entfernen, wurde das Licht durch einen 0,5 cm dicken Wasserfilter geleitet. Die 30-minütige Lichteinwirkung entspricht 2,9 × 104 J/m2 (1025 fc im Bereich von 400–700 nm, gemessen mit einem Extech Modell 401025 fc/lxm; die Umrechnung in Foot Candle beträgt 0,001496 J/s/ft2).”
Verwendung von MB zur Photoinaktivierung des West Nile Virus (WNV)
“Abb. 8. Nachweis, dass MB WNV photoinaktiviert. MB (20 M) wurde 20 Minuten lang im Dunkeln mit einer Virus-Stammlösung von WNV inkubiert und anschließend 10 Minuten lang aus einer Entfernung von 10 cm mit weißem Licht einer 40-W-Labor-Leuchtstoffröhre bestrahlt. Eine vergleichbare Virus-Stammlösung wurde ebenfalls dem Licht ausgesetzt, enthielt jedoch kein MB. Nach der Lichtexposition wurden die beiden Virus-Stammlösungen auf Vero-Zellen gegeben, bis zur Konfluenz gezüchtet und anschließend 5 Tage lang bei 37 °C inkubiert. Anschließend wurden die Ergebnisse ausgewertet. WNV übt eine zytopathische Wirkung (CPE) auf die Vero-Zellen aus und tötet sie ab. Die Inaktivierung von WNV durch MB schützt die Zellen vor einer CPE. (A) Drei Flaschen mit Giemsa-gefärbten Vero-Zellen. Die rechte Flasche zeigt, dass Vero-Zellen, die unbehandeltem WNV ausgesetzt waren, eine starke zytopathische Wirkung zeigten, die zum Auftreten großer zellfreier Bereiche in der Flasche führte. Die linke Flasche zeigt Zellen, die mit WNV behandelt wurden, das zuvor 20 M MB ausgesetzt und dann wie oben beschrieben mit weißem Licht bestrahlt worden war. Es ist deutlich zu erkennen, dass diese Zellen deutlich weniger (wenn überhaupt) CPE aufweisen. Die mittlere Flasche zeigt Zellen, die keinem WNV ausgesetzt waren. (B) Eine höhere Vergrößerung der unbehandelten Giemsa-gefärbten Vero-Zellen. Einzelne Zellen sind deutlich zu erkennen. Die Bilder in Panel (C) zeigen die Ergebnisse, die erzielt wurden, wenn das WNV nur mit Licht (oberes Panel) oder mit MB plus Licht behandelt wurde und anschließend die Viruslösung mit 1:5, 1:25, 1:125 bzw. 1:625 verdünnt wurde. Zytopathische Effekte auf die Zellen sind bei einer Verdünnung von 1:125 und möglicherweise höheren Virusverdünnungen deutlich zu erkennen.”
Historische Daten
Schon früher wurden Krankheitserreger mit Methylenblau abgetötet, um so Seren für die entsprechenden Krankheiten zu erzeugen. Ein wenig umständlich, man hätte auch den befallenen Organismus mit Methylenblau behandeln und in die Sonne stellen können statt eine so umständliche Methoden zu wählen, Seren waren aber einige Jahrzehnte en Vogue.
“Zur Abtötung der Rotlaufbazillen wurden außer Hitzeeinwirkungen (Weichlein, Stickdorn, Basset) verschiedene Farbstoffe, wie Methylenblau (Günther), ferner Rizinoleat (Basset), und mit besonderer Vorliebe Formalin (Costa, Boyer & Placidi, Muromzeff -& Malwijenko) verwendet.”
Die Zitierung (Günther) fehlt leider in der Literaturangabe des Artikels.
Selbst der Polioerreger wurde 1957 wohl mit Methylenblau inaktiviert.
20 Neuer Weg Nr. 2562, 17. Juli 1957 S. 2
“Ferner wurde festgestellt, dass er von gewissenantiseptischen Mitteln, wie von Sublimat in einer l%-Lösung, von Kaliumpermanganat in einer 2%-Lösung, von Methylenblau in einer Lösung von 1/10 III. usw. rasch vernichtet wird.
Fazit:
Dieser Übersichtsartikel kann einige der Effekte, die im frühen 20. Jhdt beobachtet wurden21 teilweise erklären, aber nur teilweise. Es sind damals weitere Effekte beschriebe worden, die man heute gar nicht (mehr) berücksichtigt oder vielleicht auch gar nicht mehr kennt.
Eines ist aber klar: Methylenblau wirkt antiviral, wenn der betroffene Organismus auch dem Licht ausgesetzt wird. Die wirksamen Lichtfrequenzen sind nicht wirklich bekannt, es kann auch eine Kombination aus Frequenzen sein. Am besten wäre meiner Meinung nach daher Sonnenlicht geeignet, da ist alles dabei.
Durch diese neueren Daten wird aber auch belegt, was die alten Ärzte schon wussten: Methylenblau wirkt besser in Kombination mit Sonnenlicht. Daher hat Methylenblau bei Tierseuchen wohl mal funktioniert und mal nicht. Im dunklen Stall wird es schlechter funktioniert haben als draußen im Auslauf.
Anwendungen bei Tieren und Tierseuchen ist aber ein anderer Artikel.
Methylenblau in Kombination mit Lichttherapie
“Die Bedeutung von Methylenblau (MB) in der photodynamischen Therapie gegen Mikroben ist gut etabliert..”
Floyd RA, Schneider JE Jr, Dittmer DP. Methylene blue photoinactivation of RNA viruses. Antiviral Res. 2004 Mar;61(3):141-51. doi: 10.1016/j.antiviral.2003.11.004. PMID: 15168794. https://pubmed.ncbi.nlm.nih.gov/15168794/
Perdrau, J.R., Todd, F.R.S., 1933. The photodynamic action of methylene blue on certain viruses. Proc. R. Soc. Lond. 112, 288–298. https://royalsocietypublishing.org/doi/pdf/10.1098/rspb.1933.0011
Perdrau, J.R., Todd, F.R.S., 1933. The photodynamic action of methylene blue on certain viruses. Proc. R. Soc. Lond. 112, 288–298. https://royalsocietypublishing.org/doi/pdf/10.1098/rspb.1933.0011
Wallis, C., Melnick, J.L., 1965. Photodynamic inactivation of animal viruses: a review. Photochem. Photobiol. 4, 159–170. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1751-1097.1965.tb05733.x?sid=nlm%3Apubmed
Heinmets, F., Kingston, J.R., Hiatt, C.W., 1955. Inactivation of viruses in plasma by photosensitized oxidation. Walter Reed Army Institute of Research Report; WRAIR-53–55, November 1955.
Foote, C.S., 1976. Photosensitized oxidation and singlet oxygen: conse quences in biological systems. In: Pryor, W.A. (Eds.), Free Radicals in Biology. Academic Press, Baton Rouge, pp. 85–124.
Foote, C.S., 1976. Photosensitized oxidation and singlet oxygen: conse quences in biological systems. In: Pryor, W.A. (Eds.), Free Radicals in Biology. Academic Press, Baton Rouge, pp. 85–124.
Die Wirkungen des fluoreszierenden Lichtes. Linzer Tages-Post N. 111, 15. Mai 1904, S. 12
Schneider JE Jr, Tabatabaie T, Maidt L, Smith RH, Nguyen X, Pye Q, Floyd RA. Potential mechanisms of photodynamic inactivation of virus by methylene blue. I. RNA-protein crosslinks and other oxidative lesions in Q beta bacteriophage. Photochem Photobiol. 1998 Mar;67(3):350-7. PMID: 9523535. https://pubmed.ncbi.nlm.nih.gov/9523535/
Die Heilwirkung des Fluoreszenzlichtes. Prager Tagblatt Nr. 127, 7. Mai 1904, S. 3
Lambrecht B, Mohr H, Knüver-Hopf J, Schmitt H. Photoinactivation of viruses in human fresh plasma by phenothiazine dyes in combination with visible light. Vox Sang. 1991;60(4):207-13. doi: 10.1111/j.1423-0410.1991.tb00907.x. PMID: 1656610. https://pubmed.ncbi.nlm.nih.gov/1656610/
Mohr H, Lambrecht B, Schmitt H. Photo-inactivation of viruses in therapeutical plasma. Dev Biol Stand. 1993;81:177-83. PMID: 8174801. https://pubmed.ncbi.nlm.nih.gov/8174801/
Mohr H. Virus inactivation of fresh plasma. Vox Sang. 1998;74 Suppl 2:171-2. doi: 10.1111/j.1423-0410.1998.tb05417.x. PMID: 9704442. https://pubmed.ncbi.nlm.nih.gov/9704442/
Corash L. Inactivation of viruses, bacteria, protozoa, and leukocytes in platelet concentrates. Vox Sang. 1998;74 Suppl 2:173-6. doi: 10.1111/j.1423-0410.1998.tb05418.x. PMID: 9704443. https://pubmed.ncbi.nlm.nih.gov/9704443/
Mohr H, Lambrecht B, Selz A. Photodynamic virus inactivation of blood components. Immunol Invest. 1995 Jan-Feb;24(1-2):73-85. doi: 10.3109/08820139509062763. PMID: 7713607. https://pubmed.ncbi.nlm.nih.gov/7713607/
Mohr H, Bachmann B, Klein-Struckmeier A, Lambrecht B. Virus inactivation of blood products by phenothiazine dyes and light. Photochem Photobiol. 1997 Mar;65(3):441-5. doi: 10.1111/j.1751-1097.1997.tb08586.x. PMID: 9077128. https://pubmed.ncbi.nlm.nih.gov/9077128/
Wagner S, Skripchenko A, Thompson-Montgomery D. Use of a flow-cell system to investigate virucidal dimethylmethylene blue phototreatment in two RBC additive solutions. Transfusion. 2002 Sep;42(9):1200-5. doi: 10.1046/j.1537-2995.2002.00163.x. PMID: 12430679. https://pubmed.ncbi.nlm.nih.gov/12430679/
ÜBER EINE METHODE DER AKTIVENIMMUNISIERUNG GEGEN SCHWEINEROTLAUF Von Prof. Dr. R. MANNINGER. Institut für Seuchenlehre und Bakteriologie der Veterinärmedizinischen Fakultät in Budapest (Eingegangen am 5. Oktober 1949.) Acta Veterinaria 1. (1951) S. 6 https://adt.arcanum.com/
https://adt.arcanum.com/
Methylenblau in Kombination mit Lichttherapie
Methylenblau in Kombination mit Lichttherapie
“Die Bedeutung von Methylenblau (MB) in der photodynamischen Therapie gegen Mikroben ist gut etabliert..”













👍