Wie man sich aus seinen eigenen Worten einen Strick dreht, weiß auch das PEI Teil 2
Die beiden deutschen WHO-Strippenzieher Pfleiderer und Wichmann und wie sie die Rolle des PEI 2014 sahen
Das PEI hat neben Dr. Sediri-Schöns Paper (https://link.springer.com/article/10.1007/s00103-022-03611-1) auch andere interessante Publikationen verfasst, welche beschreiben, worin das PEI seine eigentliche Aufgabe sieht, und die ist nicht der Verbraucherschutz, um es mal vorsichtig zu spoilern.
2014 veröffentlichten M. Pfleiderer und O. Wichman ein interessantes Paper, das bisher kaum einer zur Kenntnis genommen hat, vielleicht, weil es auf Deutsch geschrieben ist. Dieses Paper beschreibt in klaren Worten, wie das PEI seine Rolle bei der Impfstoffzulassung sieht, bzw. wie die beiden Autoren gedenken, die Rolle des PEI dementsprechend zu formen. Schwer zu sagen, ob das wirklich bereits damals die corporate identity des PEI war und was die Rolle der beiden Autoren auf dem Weg des PEI zur Pharmahure war.
Pfleiderer, M., & Wichmann, O. (2014). Von der Zulassung von Impfstoffen zur Empfehlung durch die Ständige Impfkommission in Deutschland: Kriterien zur objektiven Bewertung von Nutzen und Risiken. Bundesgesundheitsblatt, Gesundheitsforschung, Gesundheitsschutz, 58(3), 263–273. https://www.pei.de/SharedDocs/Downloads/wiss-publikationen-volltext/bundesgesundheitsblatt/2015/2015-zulassung-impfstoffe-empfehlung-stiko-kriterien-nutzen-risiko.pdf?__blob=publicationFile&v=2
Der Hintergrund der Autoren ist interessant, um abzuschätzen, wie ernst man diesen Artikel nehmen sollte/muss. Unter Interessenkonflikte der Publikation findet man folgende Informationen:
Dr. rer. nat. Michael Pfleiderer ist Leiter des Fachgebiets Virusimpfstoffe am Paul-Ehrlich-Institut. Bei der europäischen Arzneimittelagentur (EMA) ist er der Vorsitzende der Vaccine Working Party (VWP) des Ausschusses für Humanarzneimittel (CHMP) sowie Mitglied der CHMP Biologics Working Party (BWP). Beide Gruppierungen sind maßgeblich in die Entscheidungsprozesse zur Zulassung neuer Arzneimittel eingebunden.
Googelt man Michael Pfleiderer findet man auch andere interessante Informationen:
Er mischt bei biopharma-excellence mit, die sich wie folgt beschreiben:
EN: “When you’re bringing an important novel therapy/early-stage product from inception to market, you’ll want to know you’re in safe hands, and at Biopharma Excellence that’s our starting point. We’re not just a safe pair of hands: we’re experts in biotech science/product development; in biotech regulatory science and biotech regulatory affairs; and in biotech commercialization.”
DE: „Wenn Sie eine wichtige neue Therapie bzw. ein Produkt im Frühstadium von der Entwicklung bis zur Marktreife bringen, möchten Sie sicher sein, dass Sie in sicheren Händen sind. Wir sind nicht nur ein sicheres Paar Hände: Wir sind Experten in der Biotech-Wissenschaft/Produktentwicklung, in der Biotech-Zulassungswissenschaft und in Biotech-Regulierungsangelegenheiten sowie in der Biotech-Vermarktung.“
Michael Pfleiderer beschreibt sich selbst auf dieser Webseite wie folgt:
EN: "Working at PEI, EMA and WHO for almost 20 years has exposed me to virtually any imaginable regulatory challenge so however complex your needs, bring it on."
DE: "Durch meine fast 20-jährige Tätigkeit beim PEI, der EMA und der WHO bin ich mit praktisch allen erdenklichen regulatorischen Herausforderungen konfrontiert worden - egal, wie komplex Ihre Anforderungen sind, ich werde sie meistern." (https://www.biopharma-excellence.com/about-us/)
Pfleiderer ist im Scientific Advisory Board von Valneva (https://valneva.com/press-release/valneva-appoints-dr-thomas-decker-and-dr-michael-pfleiderer-to-its-scientific-advisory-board/), dem Hersteller eines eher unbekannteren, in der EU zugelassenen, Covid-Impfstoffes (https://www.br.de/nachrichten/wissen/corona-impfung-mit-valneva-so-wirkt-das-vakzin-faq,Sz1LOrr). Valneva führt ihn als „Anerkannter Experte für regulatorische Angelegenheiten und die Entwicklung von Impfstoffen; Seit 1998 Leiter der Sektion Humanvirusimpfstoffe am Paul-Ehrlich-Institut (PEI), dem deutschen Bundesinstitut für Impfstoffe und biomedizinische Forschung.“
Die Titel einiger von Pfleiderers Publikationen sagen alles, über seine Sichtweise zur Sicherheit von Impfstoffen:
Goetz KB, Pfleiderer M, Schneider CK. First-in-human clinical trials with vaccines--what regulators want. Nat Biotechnol. 2010 Sep;28(9):910-6. doi: 10.1038/nbt0910-910. PMID: 20829825; PMCID: PMC7096781.
Lambach P, Alvarez AM, Hirve S, Ortiz JR, Hombach J, Verweij M, Hendriks J, Palkonyay L, Pfleiderer M. Considerations of strategies to provide influenza vaccine year round. Vaccine. 2015 Nov 25;33(47):6493-8. doi: 10.1016/j.vaccine.2015.08.037. Epub 2015 Aug 28. PMID: 26319745; PMCID: PMC8218336.
Grippe-Impfstoffe. Herstellung, Zulassung und Weiterentwicklung. (2008, August 1). ResearchGate. https://www.researchgate.net/publication/264479172_Grippe-Impfstoffe_Herstellung_Zulassung_und_Weiterentwicklung
Pandemische Influenzaimpfstoffe. (2009, December 1). ResearchGate. https://www.researchgate.net/publication/225710433_Pandemische_Influenzaimpfstoffe
Pfleiderer, M. (2009). Stability of vaccines – Bridging from stability data to continuous safety and efficacy throughout shelf life – An always reliable approach? Biologicals, 37(6), 364–368. https://doi.org/10.1016/j.biologicals.2009.08.013
Er hat sogar eine gemeinsame Publikationen mit Klaus Cichutek:
Elmgren, L., Li, X., Wilson, C. A., Ball, R., Wang, J., Cichutek, K., Pfleiderer, M., Kato, A., Cavaleri, M., Southern, J. F., Jivapaisarnpong, T., Minor, P. D., Griffiths, E., Sohn, Y., & Wood, D. (2013). A global regulatory science agenda for vaccines. Vaccine, 31, B163–B175. https://doi.org/10.1016/j.vaccine.2012.10.117
Und auch Pfleiderer ist nicht neu im Coronavirus-Geschäft:
Flory E, Pfleiderer M, Stühler A, Wege H. Induction of protective immunity against coronavirus-induced encephalomyelitis: evidence for an important role of CD8+ T cells in vivo. Eur J Immunol. 1993 Aug;23(8):1757-61. doi: 10.1002/eji.1830230804. PMID: 8393797; PMCID: PMC7163524.
PD Dr. med. Ole Wichmann ist Leiter des Fachgebiets Impfprävention am Robert Koch-Institut. In dem Fachgebiet ist auch die Geschäftsstelle der Ständigen Impfkommission angesiedelt.
Die Geschäftsstelle der STIKO führt für die STIKO die Literaturrecherche für die Beurteilung von Impfungen durch und kann durch den BIAS der ausgewählten Literatur, die Empfehlungen der STIKO auch beeinflussen (https://www.rki.de/DE/Content/Kommissionen/STIKO/stiko_node.html).
Und da ist er wohl noch heute der Leiter https://www.rki.de/DE/Content/Institut/OrgEinheiten/Abt3/FG33/FG33_node.html und nebenbei auch noch der Vorsitzender der WHO-Impfkommission für Europa (https://www.aerzteblatt.de/archiv/229855/Ole-Wichmann-Vorsitzender-der-WHO-Impfkommission-fuer-Europa)
Die WHO schreibt über ihn:
„Dr. Wichmann ist ein in Infektionskrankheiten und Tropenmedizin ausgebildeter Arzt, der sich auf die Epidemiologie von Infektionskrankheiten spezialisiert hat. Er erhielt 2002 das Diplom in Tropenmedizin und Hygiene von der Liverpool School of Tropical Medicine und absolvierte 2003 seinen Master in klinischer Tropenmedizin in Bangkok. Am Robert-Koch-Institut (RKI) absolvierte er 2007 das 2-jährige deutsche Feldepidemiologie-Trainingsprogramm (FETP). In den Jahren 2008-2009 war er am International Vaccine Institute in Seoul als medizinischer Epidemiologe und Projektleiter tätig.
Seit 2009 ist Dr. Wichmann Leiter der Impfstelle am RKI, einer Einrichtung im Geschäftsbereich des deutschen Gesundheitsministeriums, die für die Prävention und Bekämpfung von Krankheiten zuständig ist. Das Referat ist für die Überwachung und Bekämpfung von durch Impfung vermeidbaren Krankheiten in Deutschland zuständig und führt epidemiologische Forschung durch. Das Referat beherbergt auch das Sekretariat der Nationalen Impfberatungsstelle (STIKO). Zusätzlich zu dieser Funktion ist Dr. Wichmann außerordentlicher Professor an der Charité Universitätsmedizin Berlin und stellvertretender Leiter der Abteilung für Infektionsepidemiologie am RKI.
Zu Dr. Wichmanns aktuellen Forschungsinteressen gehören die Wirksamkeit und die Auswirkungen von Impfstoffen auf Bevölkerungsebene sowie evidenzbasierte Entscheidungsfindung bei der Einführung neuer Impfstoffe in nationalen Impfprogrammen.“ (https://www.who.int/europe/about-us/about-who-europe/regional-director/regional-directors-emeritus/biography-details/dr-ole-wichmann).
Es ist also nicht überraschend, dass Dr. Wichmann bei den Leipziger Soldatenprozessen auf der Pro-Seite zu finden ist:
„Der Schutz vor einer schweren Erkrankung ist ein halbes Jahr nach dem Booster auch bei der Omikron-Variante sehr stabil und nur leicht abnehmend“, sagte der Leiter der Impfprävention beim RKI, Ole Wichmann, vor dem Bundesverwaltungsgericht in Leipzig. Der Schutz vor einem milden Verlauf oder einer Übertragung nehme mit der Zeit aber deutlich ab.( https://www.berliner-zeitung.de/politik-gesellschaft/corona-impfpflicht-fur-soldaten-rki-betont-wirksamkeit-li.233835).
Das PEI selbst ist wohl Kooperationszentrum der WHO für Impfstoffe, oder war das zumindest im Jahr 2013 (https://www.aerzteblatt.de/archiv/147273/Paul-Ehrlich-Institut-Kooperationszentrum-der-WHO-fuer-Impfstoffe) und zwar damals unter der Leitung der Abteilung von Herrn Pfleiderer (https://www.pei.de/DE/newsroom/pm/jahr/2013/07-who-ernennt-kooperationszentrum-fuer-impfstoffe-am-pei.html) .
„Mitarbeiterinnen und Mitarbeiter des WHO-Kooperationszentrums für Impfstoffe, u.a. mit Prof. Klaus Cichutek (4.v.l.).“ Quelle: PEI
Es dürfte nach diesem kurzen Überblick über die beiden Autoren, die bisher vom Namen her nicht wirklich auffällig waren, klar sein, dass eine gemeinsame Publikation dieser beiden WHO Hardliner, ein gewisses Gewicht haben dürfte. Das Paper durfte also klipp und klar beschreiben, wie das PEI selbst seine Aufgabe bei der Überwachung von Impfstoffen sieht, Gesetzeslage hin oder her.
Die Publikation ist frei verfügbar. Ich empfehle sie komplett zu lesen. Hier veröffentliche ich nur die Highlights in gekürzter Form mit einigen Kommentaren meinerseits.
Kürzungen reißen aber aus dem Zusammenhang und sind eine Form der Manipulation und natürlich habe ich einen Bias, genau wie die beiden Autoren. Ich bin aber so fair, das gleich von vorne herein klar zu stellen und meine Manipulationsmethode offen zu legen. Ich stehe halt auf satirisches Kürzen und gemeines Kommentieren. Hervorhebungen im Fettdruck sind von mir.
„Das Paul-Ehrlich-Institut (PEI), Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, ist wegen seiner Zuständigkeit für Impfstoffe besonders gefordert, durch umsichtiges Handeln seinem gesetzlichen Auftrag – nämlich die Qualität, Sicherheit und Wirksamkeit von Impfstoffen sicherzustellen – gerecht zu werden und dabei gleichzeitig Sorge dafür zu tragen, dass die Entwicklung neuer Impfstoffe nicht durch unangemessene oder schwer nachzuvollziehende regulatorische Vorschriften gefährdet wird.“
Wie z. Bsp. Kochsalz als echtes Placebo? DAS wäre doch schon ein Fortschritt bei der Impfstoffforschung und eine Nachbeobachtung der Kinder oder Impflinge über mehrere Jahre oder zumindest ein Jahr? Studien zu Aluminiumadjuvantien oder über die Gerüchte von Authismus durch Impfung? Wären nur so ein paar Vorschläge, was die Autoren als unangemessen und schwer nachzuvollziehen ansehen könnten.
„Da zur Entwicklung und Herstellung neuer Impfstoffe intensive Forschungsarbeit erforderlich ist, kann sich eine für derartige Arzneimittel zuständige Behörde bei ihrer regulatorischen Arbeit nicht darauf beschränken, auf die bestehenden gesetzlichen Regelungen zu verweisen. Eine solche Haltung würde den wissenschaftlichen Fortschritt behindern und in der Folge den Zugang zu neuen Impfstoffen erschweren.“
Im Klartext das, was man auch in Project Lightspeed lesen konnte:
„Bei „gutem Willen“ der Genehmigungsbehörden, hatte Ugur zu Kollegen gesagt, könnten schon Ende des Jahres weltweit Spritzen […] Menschen zugutekommen.“ (S 72, Zeile 10-14).
Und es scheint, die Behörden sind mehr als willig den Impfstoffherstellern nicht im Wege zu stehen, solange man ihnen eine halbwegs gummiartig belastbare Datenlage liefert.
Eine zeitgemäße regulatorische Vorgehensweise erfordert daher eine angemessene Interpretation und Umsetzung der bestehenden Arzneimittelgesetzgebung, mit dem Ziel, ein attraktives Forschungs- und Entwicklungsumfeld zu schaffen und zu bewahren, ohne dabei den oben genannten gesetzlichen Auftrag aus dem Auge zu verlieren.
Also maximal weite Auslegung von Regeln wie bei einem Ballon. Man muss halt aufpassen, dass man es nicht überspannt und der Ballon platzt und einem um die Ohren fliegt. Das scheint bei den Covid-Spritzprodukten der Fall gewesen zu sein und daher mauert das PEI so. Die stecken bis zum Hals im Sumpf.
„Um derartige Voraussetzungen bieten zu können, muss eine Behörde den gleichen Sachverstand aufweisen wie ein Impfstoffhersteller. Sie muss sich darüber hinaus international so positionieren, dass sie alle wissenschaftlichen und gesetzlichen Vorgaben zur Prüfung und Zulassung von Impfstoffen im Wesentlichen mitbestimmt.“
Man schreibt sich also die Regeln so, wie man sie braucht, und das am besten gleich zusammen mit den entsprechenden Firmen. Ein Bespiel wäre dieses Paper, welches die Vorgehensweise während der Corona-Plandemie bereist vorweg nahm:
Hinz T, Kallen K, Britten CM, Flamion B, Granzer U, Hoos A, Huber C, Khleif S, Kreiter S, Rammensee HG, Sahin U, Singh-Jasuja H, Türeci Ö, Kalinke U. The European Regulatory Environment of RNA-Based Vaccines. Methods Mol Biol. 2017;1499:203-222. doi: 10.1007/978-1-4939-6481-9_13. PMID: 27987152. https://pubmed.ncbi.nlm.nih.gov/27987152/
PEI, BioNTech/Tron und GSK kuschelig vereint auf der Autorenliste eines Buchkapitels über RNA Vaccine (https://link.springer.com/protocol/10.1007/978-1-4939-6481-9_13) und das Bereits im Jahr 2016. Sicherlich reiner Zufall.
Was den gleichen Sachverstand angeht, ich schätze, Klaus Cichutek wusste sogar deutlich mehr als jeder Wissenschaftler bei BioNTech, er war ihnen um Jahrzehnte voraus, und hat das Produkt dennoch durchgewunken.
„Unter diesen Vorgaben ist es möglich, einerseits eine optimale Qualität, Wirksamkeit und Verträglichkeit von Impfstoffen zu gewährleisten und andererseits als öffentlicher Partner der arzneimittelherstellenden Industrie zu fungieren.“
Das Wort Patientenschutz sucht man vergeblich. Hier geht es um den Schutz der Industrie. Man sieht sich als Partner der Pharmaindustrie und nicht als Schutz der Kunden dieser Industrie, wie es eigentlich gesetzlicher Auftrag des PEI wäre.
„Auf Grundlage dieser Überlegungen ist in den vergangenen Jahren das Konzept der regulatorischen oder auch zulassungs- und prüfungsbegleitenden Forschung entstanden. Dieses fordert, dass sich sowohl eine für Impfstoffe zuständige nationale Behörde wie das Paul-Ehrlich-Institut (PEI) als auch die Europäische Arzneimittelagentur (European Medicines Agency, EMA) als Mediatoren verstehen, die auf der Basis wissenschaftlich fundierter Untersuchungen die Balance zwischen gesetzgeberischen und regulatorischen Notwendigkeiten und medizinischen Problemstellungen finden.
Wie das läuft kann man in diesem Substack anhand von Originaldokumenten nachvollziehen:
Die EMA weiß, dass der DNase I - Verdau nicht funktioniert und hier sind die Dokumente, die das belegen
Diese Daten sind so brisant, dass ich sie einzeln auslager, weil sie in meinen Artikeln als Teilaspekt unterzugehen scheinen. DIE EMA WEISS, DASS DER DNASE I -VERDAU NIE FUNKTIONIERT HAT UND IMMER NOCH NICHT FUNKTIONIERT UND HAT DAS AKZEPTIERT!!!!!!!!!!!!!!
Im Übrigen war es auch die EMA, die Moderna die separate Analyse der Nanolipide erlassen hat, Moderna wollte separate Studien durchführen, welche die EMA aber überflüssig fand.
Das Thema Nanolipide wäre generell darunter zu fassen, da hat man eben eine „Balanve zwischen gesetzgeberischen und regulatorischen Notwendigkeiten und medizinischen Problemstellungen“ gefunden und akzeptiert, dass diese Stoffe nicht in der Pharmacopeia stehen, da auch nicht nachgetragen werden und man nach „in house“ Regeln mit Biotchqualität-Chemikalien herumpanschen darf, weil es sie halt nicht in pharmazeutischer Qualität gibt. Da hat man halt den pragmantischen Weg des Ignorierens gewählt.
„Dabei ist zu bemerken, dass die wissenschaftlichen und regulatorischen Aktivitäten der EMA ebenfalls vom Paul-Ehrlich-Institut, in Zusammenarbeit mit allen anderen EU- Arzneimittelbehörden bzw. Agenturen, begleitet werden. Die regulatorische Forschungskapazität der Arzneimittelbehörden soll Impfstoffherstellern eine ideale Plattform bieten, um die Produktentwicklung und Zulassung effizient vorantreiben zu können.“
Eine Erfindung dieser „idealen Plattform“ und des „effizienten Vorantreibens“ wäre die Teleskopierung und das „rolling Review-Verfahren“ bei den Covid-Injektionen. Man kam den Herstellern eben entgegen und hat ihnen eine ideale Plattform mit sehr entgegenkommenden Verträgen und Haftungsbefreiung geliefert.
„Ein gut funktionierender Impfstoffmarkt, der den Ansprüchen aller Beteiligten gerecht werden soll, hängt im Wesentlichen von der integrativen Kompetenz der zuständigen Kontrollinstanzen ab.“
Impfstoffmarkt zeigt bereits als Wort, dass es hier nicht um Schutz der Bevölkerung geht, sondern um ein großes Geschäft in das die Kontrollinstanzen integriert sind, über die Gebühren, die die Hersteller an diese Kontrollinstanzen zahlen. Die FDA finanziert sich zum großen Teil aus diesen Gebühren der Hersteller. Die Kontrollinstanzen sind somit in gewisser Weise sowohl Kunden als auch Zuhälter von Big Pharma. Feiner ausgedrückt nennt man das „regulatory capture“, was juristisch eine ganze besondere Form der Korruption auf staatlicher Ebene beschreibt.
„Die Risiken, die mit der Anwendung von Impfstoffen verbunden sind, dürfen daher kaum wahrnehmbar sein.“
Und wenn sie wahrnehmbar werden, unterdrückt und zensiert man die Opfer, fälscht die Statistiken oder nimmt Nebenwirkungen einfach nicht in die Datenbank auf. Bzw. man organisiert das Bezahlungssystem der Ärzte so, dass es sich finanziell nicht rentiert, Nebenwirkungen zu melden und Impfschäden nicht von der Krankenkasse übernommen werden, so dass der Arzt gezwungen ist, will er seinen Patienten behandeln, diese anders zu kodieren.
„Die Zulassung von Impfstoffen geht vornehmlich der Frage nach, ob ein bestimmter Impfstoff sicher, wirksam und qualitativ hochwertig und sein Nutzen-Risiko-Verhältnis akzeptabel ist.“
Qalitativ hochwertig… sein Nutzen-Risiko-Verhältnis akzeptabel.
Das liegt im Auge des Betrachters, würde ich sagen, genau wie das Nutzen-Risiko-Verhältnis.
Dazu wurden aber schon sehr viele Aufsätze geschrieben.
„Anders als bei therapeutischen Arzneimittel steigt die Wirkung eines Impfstoffes, d. h. die Auslösung einer Immunantwort, in der Regel jedoch nicht parallel zur Erhöhung der Dosis“
DAS sieht BioNTech definitiv anders:
«Da wir nicht wissen, was nötig ist, sollten wir beim Maximum anfangen», hatte Ugur erklärt.“ (Project Lightspeed S. 220).
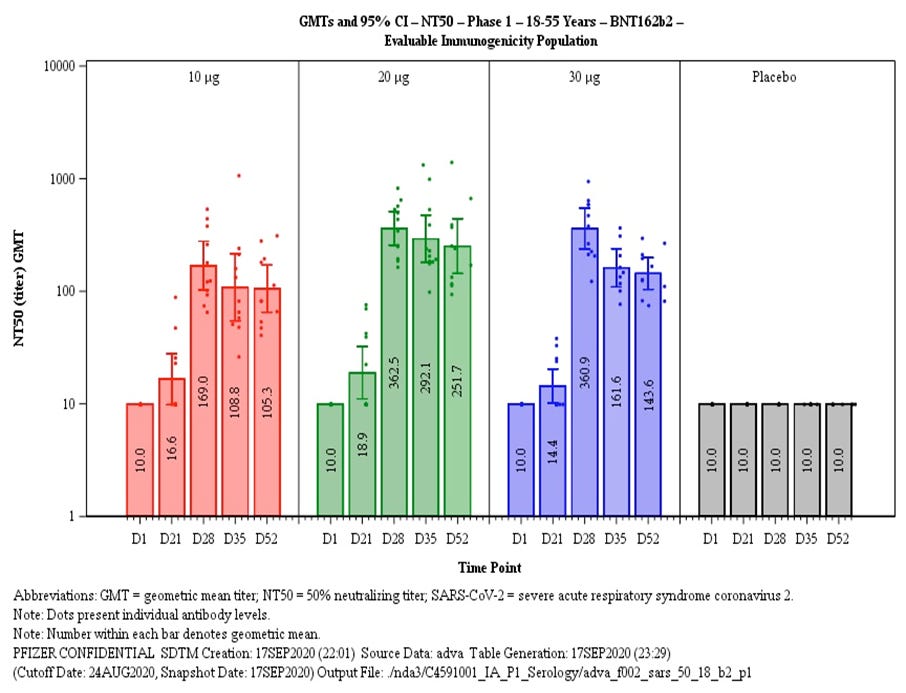
„Die vorläufigen Ergebnisse, die Muik übermittelt hatte, zeigten, dass dies die Möglichkeit eines funktionierenden Impfstoffs nicht einschränkte. Ganz im Gegenteil. «Wir wussten nun, dass 10 Mikrogramm, vielleicht 30 Mikrogramm, genügen konnten»“ (Project Lightspeed S. 241).
Und daher hat man „sicherheitshalber“ 30µg genommen, obwohl die Daten klar zeigten, dass 20µg besser und sicherer waren.
20µg waren besser als 30 µg nach 52 Tagen bei geringeren Nebenwirkungen.
Und die Behörden haben das nach BioNTechs Aussage so durchgewunken:
„Allerdings birgt der Einsatz immunmodulierender Substanzen immer das Risiko einer systematisch fehlgeleiteten oder überschießenden Immunantwort, […]“
Diese Aussage bezieht sich zwar auf Adjuvantien, aber BioNTech sieht die Nanolipide auch als praktische Adjuvantien an. Zudem stellt sich auch die Frage, in wieweit die modRNA-Produkte auch als immunmodulierend angesehen werden können, da sie so konstruiert wurde, dass sie die Erkennung der modRNA über Tor-like Rezeptoren ausschalten.
„Startpunkt ist das Erkennen eines Risikos. Wie Abb. 2 zeigt, werden hierfür die einzelnen Komponenten des Impfstoffs geprüft.“
Leider hat man die Lipide jedoch NICHT separat geprüft. Das PEI verstößt hier somit sträflich gegen seine sonst angeblich übliche Vorgehensweise.
https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf
„Ist die Anwendung des Impfstoffes aufgrund seiner Struktur, seiner Hilfsstoffe oder der Art seiner Anwendung mit einem möglichen Risiko behaftet? Wie verlässlich sind die Daten zur Sicherheit, die man durch Prüfung im Labor oder am Tier erhalten hat?“
DAS ist eine wirklich gute Frage, zumal es gar keine Tiermodelle gibt, die das volle Spektrum menschlicher Myocarditis abbilden:
Und die Affenmodelle sogar als Kranheitsmodell ungeeignet waren laut Hersteller.
(https://pubmed.ncbi.nlm.nih.gov/33524990/)
Ob 8 bis 16 Mäuse ausreichend waren, um die Sicherheit des Omikron Boosters zu testen? Das kann wohl nur das PEI beantworten.
„Bei der Wahl eines Tiermodells wird man sehr genau darauf achten müssen, ob es erstens aussagefähige Daten zur Toxizität liefern kann und ob es zweitens mit dem Krankheitserreger infiziert werden kann, gegen den sich der Impfstoff wendet.
Infizieren konnten sich die Affen aus der BioNTech Studie durchaus, sie werden halt nicht krank von diesem Virus, das ist der Haken. Vom Wortlaut her war die PEI Bedingung aber soweit erfüllt. Toxiziätsstudien gab es jedoch nicht:
tps://www.tga.gov.au/sites/default/files/foi-2389-06.pdf
Vielleicht, weil man wusste, dass das Produkt OEB5 (very highly hazardous = Sehr hoch gefährlich) war und man keine Lust hatte, dass das auffallen würde? Irgendwie muss man doch die Sicherheitseinstufung vorgenommen haben? Wie eigentlich?
ttps://phmpt.org/wp-content/uploads/2023/11/125742_S11_M3_32r_pf-07302048-dp-rm-coa.pdf
„Je nach Erreger hängt das Risiko für eine Erkrankung bzw. das Risiko, bei Infektion einen schweren Krankheitsverlauf zu entwickeln, unter anderem vom Alter, von möglichen Grunderkrankungen oder auch vom Aufenthaltsort ab“
Und daher mussten alle, vom risikolosen Säugling bis zum Greis geimpft werden?
„Schlussendlich kann es durch die breite Anwendung einer Impfung in seltenen Fällen auch zu negativen Effekten auf Bevölkerungsebene kommen, wie […] zu einem Replacement von im Impfstoff befindlichen Erregerserotypen mit nicht im Impfstoff befindlichen Typen (z. B. bei der Pneumokokkenimpfung.“
Obwohl man das weiß, impft man immer noch gegen Pneumokokken.
Obwohl man das weiß, und beobachtet hat, dass die Coronaviren den durch das Produkt erzeugten Antikörpern durch Mutation ausweichen, hat man weiter geimpft, in der Hoffnung, dass das irgendwann aufhört?
„Nach der breiten Anwendung einer Impfung in der Bevölkerung müssen jedoch Systeme vorhanden sein, die eine kontinuierliche Evaluation der jeweiligen Impfung bzw. der durch sie verursachten Effekte auf die Zielkrankheit erlauben. […]“
Dafür gab es die SafeVacApp (https://www.pei.de/DE/newsroom/hp-meldungen/2020/201222-safevac-app-smartphone-befragung-vertraeglichkeit-covid-19-impfstoffe.html), deren Auswertung und Daten bis heute nicht vorliegen. Kontinuierliche Evaluation stelle ich mir irgendwie anders vor. Irgendwie mit zeitnaher Datenauswertung und Veröffentlichung dieser erhobenen Daten. Vor allem sollten auch die Chargen erhoben und protokolliert werden, was man geflissentlich unterlassen hat.
„Dazu gehören ein Monitoring der Krankheitslast in den verschiedenen Altersgruppen vor und nach Einführung der Impfung (z. B. auf Basis von IfSG- Meldedaten), eine kontinuierliche Erhebung der Impfquoten (zur Beurteilung der epidemiologischen Effekte), eine Pharmakovigilanz-Surveillance (die auch sehr seltene unerwünschte Arzneimittelwirkungen detektiert) und eine molekulare Surveillance des Erregers (die z. B. mögliche Escapemutanten oder Replacementphänomene aufdeckt).“
Da hätte einem ja auffallen können, wie den Briten oder Australiern, dass vor allem die Behandelten Personen mit der entsprechenden Krankheit im Krankenhaus landeten? Das wollte man wohl in Deutschland vermeiden.
„Post-Marketing-Studien zur Impfeffektivität sind insbesondere dann von Bedeutung, wenn die Zulassung eines Impfstoffs nur auf Immunogenitätsstudien beruhte […].“
Ja, die Post-Marketing-Studien gibt es unter diesem Link: https://phmpt.org/wp-content/uploads/2022/04/reissue_5.3.6-postmarketing-experience.pdf
Die Daten sahen sehr, sehr schlecht für das Produkt aus.
Das PEI ignorierte die Post-Marketing-Studie einfach. SO wichtig und von Bedeutung war sie für das PEI. Dabei war eine der Hauptnebenwirkungen: COVID-19.
Das taufte man in Impfdurchbrüche um, statt das Kind beim Namen zu nennen: Produktversagen.
„Dies ist erforderlich, um einerseits den weltweit einheitlichen Zugang zu modernen Impfstoffen zu gewährleisten, und andererseits um zu vermeiden, dass über ein und denselben Impfstoff unterschiedliche wissenschaftliche Schlussfolgerungen gezogen werden. Entsprechend arbeiten die großen europäischen Zulassungsbehörden (EMA und nationale Behörden) schon seit Langem intensiv zusammen, vermehrt auch unter Beteiligung der WHO und im Rahmen von wissenschaftlichen und regulatorischen Beratungen, immer unter Beteiligung der Impfstoffhersteller.
Das lässt sich einfach mit wenigen Worten zusammenfassen:
Zensur von Nebenwirkungen und Warnhinweisen durch Behörden und Hersteller.
OK, an dieser Stelle habe ich diese Aussage aus den Kontext gerissen, aus dem sie stammt. Ganz böse manipulativ von mir.
Letztendlich wird hier vor allem die lückenlose Zusammenarbeit von Hersteller und nationalen Behörden mit der EMA gefordert, damit nicht ein Land was anderes sagt als ein anderes Land. ABER, wenn ich das hier nicht offengelegt hätte, hättest Du, lieber Leser, den Kontext geprüft? So als Übung in Medienkompetenz? Oder hat dich der obige Satz so richtig schön aufgeregt und deinen Blutdruck in die Höhe getrieben? Glaubst Du ernsthaft, das hätten sie sonst so in ihren Text geschrieben? So dreist waren sie damals noch nicht.
Wie auch immer.
Die beiden Autoren Michael Pfleiderer und Ole Wichmann sind, meiner persönlichen Meinung nach, WHO-U-Bote und Pharmalobbyisten ersten Ranges, die das PEI dazu nutzen, die Ziele der Pharmaindustrie unter dem Deckmantel des Patientenschutzes durchzudrücken. Vielleicht war das PEI auch aktiv bei diesem Spiel beteiligt.
Wenn es zu einer Aufarbeitung kommt, sollten diese beiden Namen,
Dr. Michael Pfleiderer und
Dr. Ole Wichmann,
mit auf der Liste derjenigen stehen, die man einer hochnotpeinlichen Befragung unterzieht, bezüglich ihrer Rolle bei dieser Plandemie, gleich neben
Dr. Klaus Cichutek,
Dr. Sediri-Schön und
Dr Volker Öppling.




















Ach du meine Güte. Gerade die Präsentation von DrBine bei Corona Ausschuss 187 gesehen.
https://odysee.com/@Corona-Ausschuss:3/s187de:1
Umwerfend. Mir war schon bekannt, dass die EMA ihre eigene Vorschriften i.B.a DNA Kontamination übersah, aber DrBine hat mir dazu viel Neues beigebracht.
Vielen herzlichen Dank an DrBine!
„Je nach Erreger hängt das Risiko für eine Erkrankung bzw. das Risiko, bei Infektion einen schweren Krankheitsverlauf zu entwickeln, unter anderem vom Alter, von möglichen Grunderkrankungen oder auch vom Aufenthaltsort ab“
Wow, welch bahnbrechende Erkenntnis, da sind ja wirklich hochkarätige Wissenschaftler am Werk. Auf sowas muss man erstmal kommen, das geht nur mit Expertise und viel Nachdenken ... und einer Werbeagentur.
Egal, danke für den schönen Bericht und die Links, die Mühe lohnt sich.