Kationische Nanolipide: was die Hersteller den Behörden bewusst verschwiegen haben
Pfizer hat verschwiegen, dass
Weil die wenigsten bei langen Texten bis zum Ende lesen, kommt die Conclusion hier versuchsweise mal am Anfang.
Richter wollen Bildzeitungsüberschriften / Klickbait, also versuche ich auch das.
Was werden wir nach dem Lesen dieses Artikels gelernt haben (Futur II kann man so selten einsetzen):
Pfizer hat verschwiegen, dass
1. kationische Nanolipide bekanntermaßen CARPA Reaktionen verursachen können. CARPA Reaktionen sind Komplement aktivierte Pseudoallergien, die nicht vorhersagbar, nicht testbar, schnell oder langsam eintreten können und mitunter tödlich enden. 5% bis 45% der Menschen reagieren mit einer CARPA Reaktion auf Nanolipide im Gegensatz zu weniger als 2% auf Penicillin. Das Problem ist seit mindestens 2014, eigentlich schon früher bekannt.
2. die Nanolipidkolloide sich eine Corona aus körpereigenen Proteinen zulegen, die von Mensch zu Mensch variiert und die Wirkung des Produktes und dessen Zielort massiv beeinflussen. Das war von Onpattro, mit dem man sich in der Zulassung verglich, bekannt.
3. die Qualität des PEGylierten Nanolipids die Stabilität und das Nebenwirkungsprofil des Produktes beeinflusst. ABER man hat zumindest das allergene Potential des PEG thematisiert.
4. die Tiefe der Injektion in den Muskel, den Zielort des Produktes beeinflusst. Das wusste man seit 2015.
=== Einleitung ===
A mother‘s Anthem (https://amothersanthem.substack.com/) hat, was die Nanolipide angeht, auf ihrem Substack sehr gute Arbeit geleistet, auch wenn ich nicht in allen Punkten mit ihr übereinstimme. Ich werde in meinem Artikel daher Einiges vorsichtiger formulieren, als sie es getan hat.
Ihr Substack und ihr Gutachten ist jedoch für deutsche, lesefaule Richter, die es wortwörtlich „auf Bildzeitungsüberschriften heruntergebrochen haben wollen“ mit 86 Seiten minimum 80 Seiten zu lang. Zudem interessiert deutsche Gerichte nicht die Bohne, welche Regeln in anderen Ländern gelten. Für meine Leserschaft, die erstaunlicher Weise, zu einem großen Teil aus Anwälten, Ärzten und Politikern besteht, muss ich das umformulieren, anders strukturieren und ich werde auch noch einige meiner Daten hinzufügen, die „A mother’s Anthem“ nicht hat und das Niveau noch einmal deutlich senken, damit es auch ein Richter versteht, der Biologie und Chemie nach der 11. Klasse abgewählt hat. Dennoch ist „A mother’s Antems“ Literaturliste des Gutachtens die Basis auf der ich aufgebaut habe. Ich empfehle daher allen, die es ausführlicher wollen mit vielen Erklärungen und Definitionen für Laien, die Originale zu lesen.
Ich werde den Inhalt von „A mother’s Anthem“ massiv straffen und eine extreme Informationsverdichtung durchführen, damit der Text nicht zu lang wird. Daher, wenn die Informationsdichte zu hoch ist, ins Original gehen, da wird das auf 86 Seiten mit vielen Wiederholungen und Erklärungen in kleinen Schritten erklärt.
Da sich der Text an Anwälte richtet, werde ich auch nicht wie üblich mit Fußnoten zitieren, sondern Links im Text statt einer Fußnote setzen, wie es wohl in Deutschland bei derartigen Dokumenten üblich ist. Das macht das 1:1 Kopieren für meine Klientel ein wenig einfacher. Sie müssen dann nur noch die Ironie und den Sarkasmus entfernen.
=== Folgende drei kationischen Nanolipide sind aktuell im medizinischen Einsatz zugelassen===
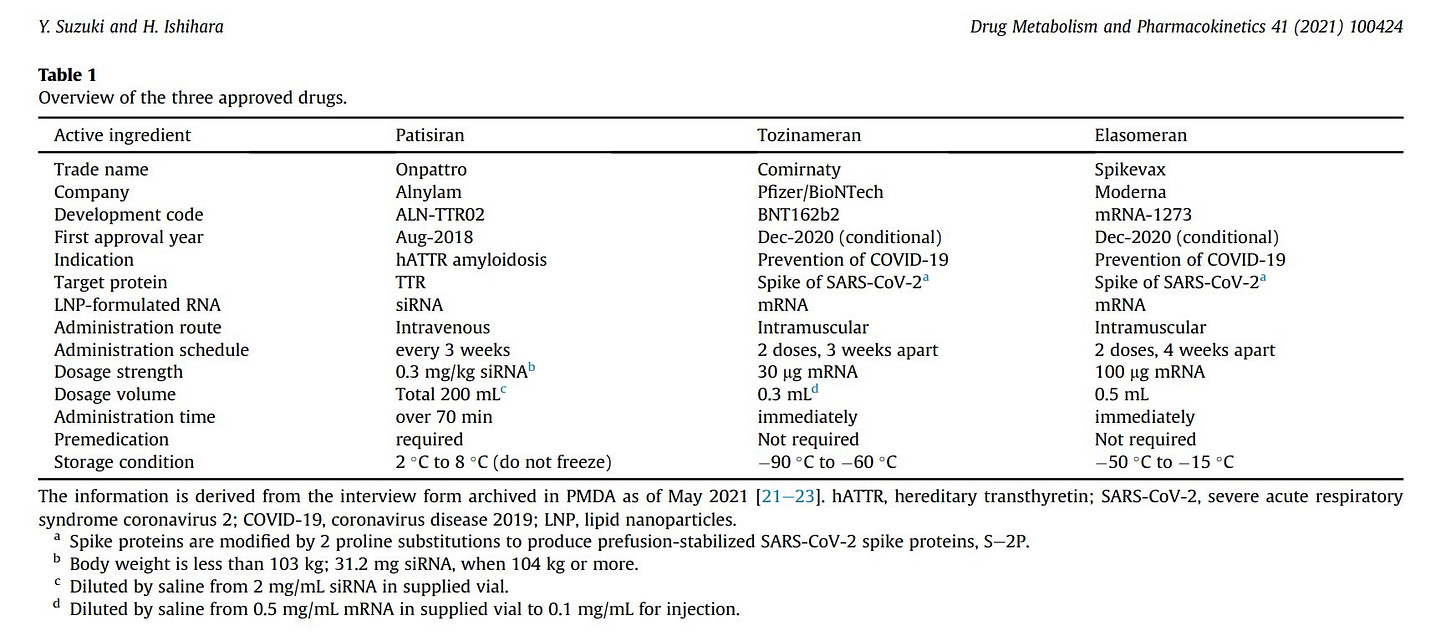
Aktuell sind 3, meiner Meinung nach strukturell sehr unterschiedliche, kationische Nanolipide (ionazable lipids) für den medizinischen Einsatz im Menschen zugelassen (https://doi.org/10.1016/j.dmpk.2021.100424):
1. Dlin-MC3-DMA (Onpattro)
2. ALC-0315 (Comirnaty)
3. SM-102 (Spikevax)
Ich bin kein Chemiker, aber auf den ersten Blick erscheinen mir die Strukturformeln der drei kationischen Nanolipide recht unterschiedlich.
Das sieht Pfizer übrigens genauso (https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf)
Obwohl Dlin-MC3-DMA und ALC-0315 strukturell nichts miteinander gemeinsam haben, außer der generellen Tatsache, dass es beides kationische Nanolipide sind, hat Pfizer Dlin-MC3-DMA verwendet, um zu zeigen, dass ALC-0315 harmlos ist und man daher keine Studien durchgeführt hat, in welchen man nur ALC-0315 allein als Substanz auf seine Toxizität hin überprüft hat.
Also harmlos insoweit als dass Dlin-MC3-DMA Leber, Milz, Nebennierendrüsen, Hoden und Lymphknoten als Ziel hat und dort Probleme verursachen kann, für die Dlin-MC3-DMA bekannt ist, was man leider nicht explizit dazugeschrieben hat. Vielleicht hat man sich auch deshalb das gespart, weil die EMA das aus ihrem Onpattro EPAR Report ohnehin bereits wusste (https://www.ema.europa.eu/en/documents/assessment-report/onpattro-epar-public-assessment-report_.pdf).
Was man der EMA auch verschwiegen hat war, dass ALC-0315 früher von Moderna verwendet wurde, etwa bis 2017, als man einsehen musste, dass man die Nebenwirkungen, die ALC-0315 verursachte, einfach nicht in den Griff bekam.
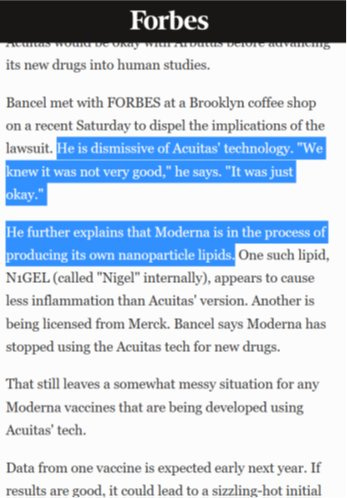
Bancel, der Chef von Moderna, äußerte sich im Forbes Magazin dazu wie folgt:
(https://www.forbes.com/sites/nathanvardi/2016/12/14/modernas-mysterious-medicines/#19ea9831730e)
Warum bezeichnete Bancel die ALC Lipide von Acuitas als „nicht sehr gut“?
Man hatte versucht, eine Gentherapie gegen die Leberkrankheit Crigler-Najjar zu entwickeln, eine Erbkrankheit, bei welcher ein Gen in der Leber nicht mehr richtig funktioniert. Dieses Gen wollte man ersetzen. Da ALC-0315 die Leber als Ziel hat, war das eine optimale Kombination. Unglücklicherweise war ALC-0315 bei mehrfacher Injektion, die sich als notwendig erwies, schlecht für die Leber. Das hat Moderna beinahe ruiniert bzw. die Entwicklung des Medikamentes auf „unbestimmte Zeit verschoben“ (https://www.statnews.com/2017/01/10/moderna-trouble-mrna/). Man beschloss daher auf Impfstoffe umzusatteln.
Moderna trennte sich daraufhin von der Acuitas ALC-Plattform und entwickelte eigene kationische Nanolipide, die SM-Plattform.
Die von Moderna ausgemusterten ALC-Lipide waren nun also für andere Firmen als Lizenz verfügbar, die Moderna eigenen SM-Lipide nicht. Obwohl die ALC-Lipide unkontrollierbare Nebenwirkungen verursachten entschied sich BioNTech daher (zwangsweise?) für die einzig verfügbare Plattform, die ALC-Plattform, welche laut Moderna folgende Nebenwirkungen verursachen können:
„Unsere LNPs könnten ganz oder teilweise zu einer oder mehreren der folgenden Reaktionen beitragen: Immunreaktionen, Infusionsreaktionen, Komplementreaktionen, Opsonierungsreaktionen, Antikörperreaktionen, einschließlich IgA, IgM, IgE oder IgG oder einer Kombination davon, oder Reaktionen auf das PEG von einigen Lipiden oder PEG, die anderweitig mit dem LNP verbunden sind. Bestimmte Aspekte unserer Prüfpräparate können Immunreaktionen entweder durch die mRNA oder das Lipid sowie Nebenwirkungen innerhalb der Leberwege oder den Abbau der mRNA oder des LNP hervorrufen, die in einer oder mehreren unserer klinischen Studien zu signifikanten unerwünschten Ereignissen führen können.
(https://www.sec.gov/Archives/edgar/data/1682852/000119312518323562/d577473ds1.htm S. 33)
Eines muss man Moderna lassen, sie waren offen und ehrlich was die potentiellen Risiken anging. Moderna hat nicht versucht, bekannte, offensichtliche Daten zu verschleiern oder zu verstecken. Sie haben versucht, das Problem in den Griff zu bekommen, indem sie andere kationische Nanolipide entwickelt haben.
BioNTech/Pfizer hingegen haben durch ihr Dlin-MC3-DMA Manöver versucht, zu verschleiern, dass die ALC-Plattform möglicherweise sogar noch problematischer von den Nebenwirkungen ist, als Dlin-MC3-DMA. Da hat man sich lieber mit dem kleineren Übel verglichen.
Was man dabei aber auch unterschlagen hat ist: Dlin-MC3-DMA ist derartig immunogen, dass man die Patienten die mit Onpattro/Patisiran behandelt werden, vorbehandeln muss und das Mittel als sehr langsame Infusion verabreicht wird (alle 3 Wochen).
Vorbehandelt wird eine Stunde vor Verabreichung mit intavenösem Dexamethasone (10 mg), oral paracetamol/acetaminophen (500 mg) intravenösem H2 Blocker (wie Ranitidine 50 mg oder Famotidine 20 mg), intravenösem H1 Blocker (wie Diphenhydramine 50 mg). Als Alternative zum H1 Blocker: Hydroxyzine oder Fexofenadine 25 mg (oral) oder Cetirizine 10 mg (oral). (https://www.ema.europa.eu/en/documents/assessment-report/onpattro-epar-public-assessment-report_.pdf)
Es scheint so, als wenn H2 Blocker in Deutschland aktuell jedoch nicht zu bekommen wären, laut einer befreundeten Ärztin. Was für ein Pech.
Warum hat man die Patienten, die mit Onpattro (ein Mittel gegen Amyloidose) behandelt werden, mit all diesen Medikamenten vorbehandelt?
Wegen der sogenannten Infusionsreaktionen = Komplementreaktionen = CARPA, die Moderna in seinem Börsenbericht auch explizit ausführt.
Hat man diesen Umstand bei den COVID-19 Schlumpfungen beachtet?
Hat man die Impflinge vorbehandelt?
Hat man die Impflinge, die EMA, die FDA über die bekannten, zu erwarteten Infusionsreaktionen = Komplementreaktionen = CARPA vorher in Kenntnis gesetzt?
Ganz im Gegenteil, man riet sogar davon ab, Paracetamol zu nehmen (https://www.aerzteblatt.de/archiv/218451/Nebenwirkungen-bei-COVID-19-Impfung-Nicht-zu-frueh-therapieren) obwohl es sogar nur eines der vielen Mittel ist, die man VORHER hätte einnehmen müssen, um eine CARPA Reaktion zu verhindern.
Science berichtete im Dezember 2020 über das PEG und CARPA Problem, das zu diesem Zeitpunkt vermutlich bereits 8 Menschen getötet hatte (https://www.science.org/content/article/suspicions-grow-nanoparticles-pfizer-s-covid-19-vaccine-trigger-rare-allergic-reactions).
Daher, wurde wegen PEG und schneller allergischer Reaktionen, die 30 min Wartezeit Regel. Der Hacken: CARPA Reaktionen können sich auch erst über Wochen entwickeln und sind nicht unbedingt durch das PEG ausgelöst, sondern durch die Struktur des Kolloids. Das hat man nicht sauber getrennt.
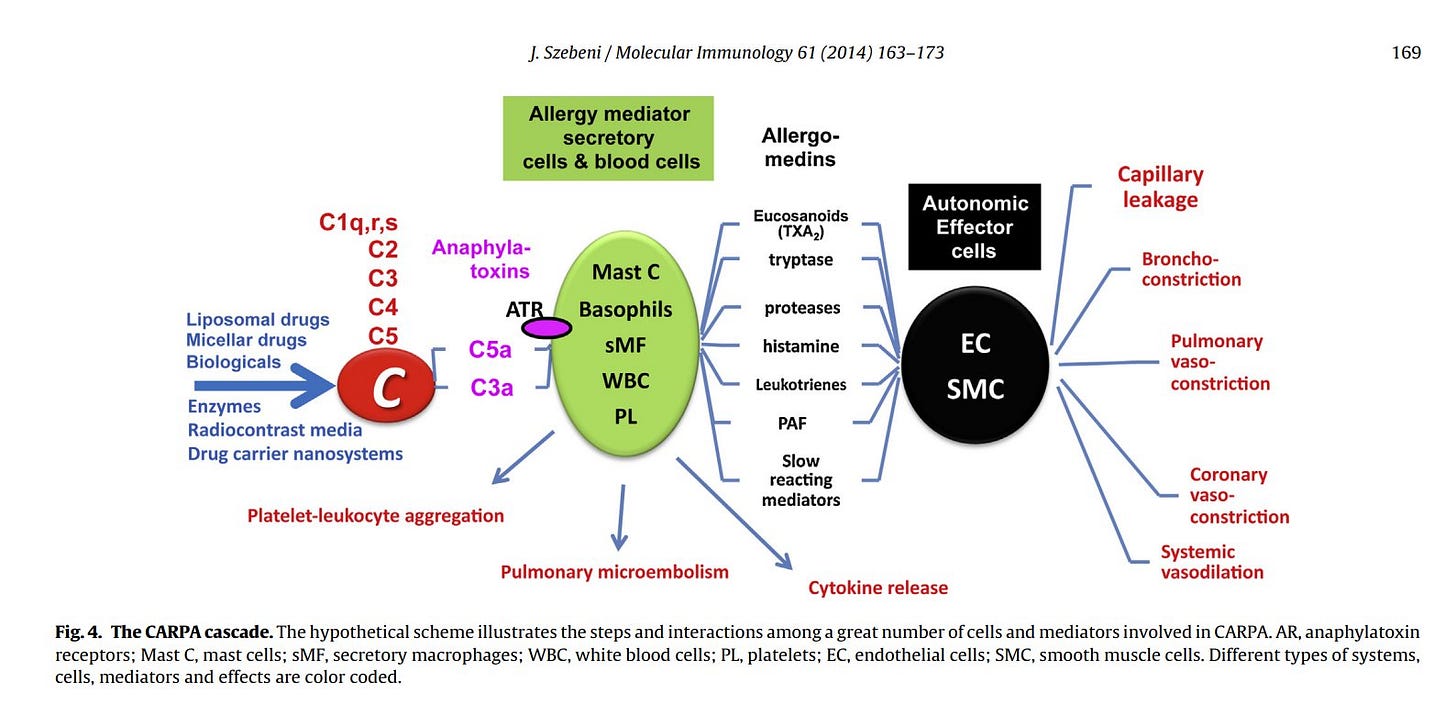
=== Das CARPA Problem ===
Janos Szebeni – Komplementaktivierungsbedingte Pseudoallergie: Eine Stressreaktion im Blut, ausgelöst durch Nanomedikamente und Biologika (Complement activation-related pseudoallergy: A stress reaction in blood triggered by nanomedicines and biologicals) (https://doi.org/10.1016/j.molimm.2014.06.038)
EN: Intravenous injection of a variety of nanotechnology enhanced (liposomal, micellar, polymer-conjugated) and protein-based (antibodies, enzymes) drugs can lead to hypersensitivity reactions (HSRs), also known as infusion, or anaphylactoid reactions. The molecular mechanism of mild to severe allergy symptoms may differ from case to case and is mostly not known, however, in many cases a major cause, or contributing factor is activation of the complement (C) system. The clinical relevance of C activation-related HSRs, a non-IgE-mediated pseudoallergy (CARPA), lies in its unpredictability and occasional lethal outcome.
DE: Die intravenöse Injektion einer Vielzahl von nanotechnologisch verbesserten (liposomal, mizellar, polymerkonjugiert) und proteinbasierten (Antikörper, Enzyme) Arzneimitteln kann zu Überempfindlichkeitsreaktionen (HSR) führen, die auch als Infusions- oder anaphylaktoide Reaktionen bekannt sind. Der molekulare Mechanismus der leichten bis schweren Allergiesymptome kann von Fall zu Fall unterschiedlich sein und ist größtenteils nicht bekannt, jedoch ist in vielen Fällen eine Aktivierung des Komplementsystems (C) eine Hauptursache oder ein mitwirkender Faktor. Die klinische Relevanz der C-aktivierungsbedingten HSR, einer nicht IgE-vermittelten Pseudoallergie (CARPA), liegt in ihrer Unvorhersehbarkeit und ihrem gelegentlich tödlichen Ausgang.
CARPA steht für Complement Activated Reaction Pseudo Allergy)
CARPA ist unvorhersehbar, somit nicht vorher durch einen Allergietest testbar (der wäre IgE) und CARPA kann tödlich enden.
IgE, Komplementreaktion, Infusionsreaktion,… das kommt einem aus dem Börsenbericht von Moderna irgendwie bekannt vor.
Einige der Symptome in diesem Paper kommen einem aus der Nebenwirkungsliste der Plörre bekannt vor.
Einige Symptome in dieser Abbildung kennt man aber auch als Shedding-Symptomatik. Ich persönlich weiß, wegen Kontakt zu einer beschädigten Vial, dass ich auf die Lipide reagiere, aber nicht auf das Spike-Protein. Meine Symptome aus der obigen Liste umfassen: Husten (geringe Dosis), Schwindel, Kopfschmerzen (wenn ich mehr abbekomme) und wenn ich zu viel abbekomme wird es systemisch (das habe ich im Urlaub letztes Jahr zwei Mal ausgereizt): Fieber, Schüttelfrost, Schweißausbrüche und eine Woche krank im Bett.
An dieser Stelle frage ich mich, hätte ich die Plörre genommen… wahrscheinlich wäre ich dann nicht mehr am Leben oder zumindest hätte ich wohl eine fiese CARPA Reaktion entwickelt, wenn bei mir schon kleinste Mengen des eingeatmeten Lipids reichen für eine Symptomatik.
Was beeinflusst die CARPA Reaktion, was sollte man also vermeiden, damit es nicht so schlimmer wird?
Und was hat man getan?
Positive oder negative netto Oberflächenladung (https://doi.org/10.1038/nrd.2017.243):
EN: […] the lipid-to-mRNA ratio, and thus the net charge of the particles, has a profound impact on the biodistribution of the vaccine. While a positively charged lipid particle primarily targeted the lung, a negatively charged particle targeted DCs in secondary lymphoid tissues and bone marrow.
DE: […] das Verhältnis von Lipid zu mRNA und damit die Nettoladung der Partikel hat einen tiefgreifenden Einfluss auf die biologische Verteilung des Impfstoffs. Während ein positiv geladenes Lipidpartikel in erster Linie auf die Lunge abzielt, zielt ein negativ geladenes Partikel auf DCs in sekundären lymphatischen Geweben und im Knochenmark ab.
Man hatte dendritische Zellen als Ziel, also somit eine negative Ladung, schätze ich. Wirklich neutrale Partikel zu erzeugen, würde ein SEHR genaues Mischungsverhältnis von positivem Lipid und negativer modRNA erfordern. Das exakt zu treffen ist eher ein Glücksfall, würde ich vermuten. Die Kolloide sind also entweder positiv, oder negativ geladen, manchmal vielleicht auch neutral.
Was die Größe der Liposomen angeht, war man großzügig:
(https://files.catbox.moe/cnkfc7.pdf) aber eigentlich klein genug, dass das Immunsystem nicht allzu sehr hochdrehen sollte, wenn man sich wirklich an die Größenangaben gehalten hat.
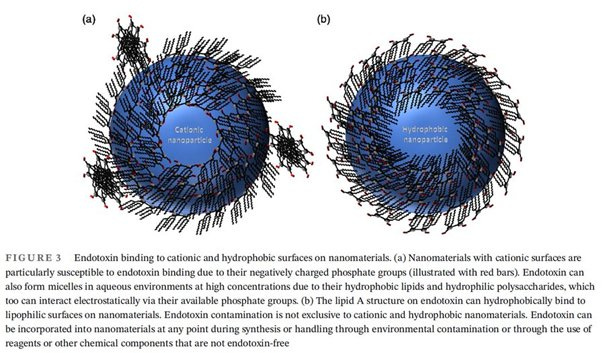
Endotoxine: Aktuell wird auf Substack heiß diskutiert, ob die CARPA Reaktion nun allein an den LNPs liegt oder an Endotoxinverunreinigungen bzw. an Endotoxinen, die an die LNPs gebunden haben (https://twitter.com/FluoridePoison/status/1711841677974118610) und somit Teil der Corona sind.
Ganz von der Hand zu weisen ist das nicht. Es gibt eine Untersuchung an Ratten mit nach Karikó korrekt gereinigter, nicht kodierender mRNA befüllt, um deren Immunogenität zu minimieren. Da gab es hauptsächlich Entzündungen, durch das angeborene Immunsystem ohne CARPA. Die beobachteten Gewebeschäden waren aber dennoch erheblich und CARPA Reaktionen werden im Paper zumindest erwähnt, aber nicht als Ursache genannt (https://doi.org/10.1016/j.isci.2021.103479).
ABER:
Endotoxine in klassischen Impfstoffen sind in deutlich höherer Konzentration zugelassen und akzeptiert (https://doi.org/10.1002/jps.22267) als in den modRNA-Produkten.
Selbst eine einmalige Überschreitung der Grenzwerte jenseits des Mumps Impfstoffes, wäre vor Gericht dann nur für diese eine Charge relevant und würde die modRNA-Plattform nicht deligitimieren.
Ob es nun die Endotoxine sind oder die Lipide sind, die CARPA auslösen ist für mich somit aktuell eine rein akademische Frage ohne praktischen Nutzen vor Gericht, da man das aktuell bei den im Umlauf befindlichen Produkten kaum sauber unterscheiden kann.
Was die Aggregate angeht, hat BioNTech/Pfizer so richtig ins Klo gegriffen, als sie am Anfang mit Phosphatpuffer gearbeitet haben, was zu Flokkulation, also Aggregation führen musste (https://doi.org/10.56098/ijvtpr.v3i1.68), besonders, wenn man mit Kochsalz verdünnt. Da wusste man bei BioNTech auch ganz genau (https://patents.google.com/patent/US20150086612A1/en) seit mindestens 2013.
Hoher Cholesterolanteil in der Membran? Wenn das Cholesterol im Produkt (nachträglich, nach der Filtration?) auskristallisiert und in einem Schülermikroskop gut sichtbar ist, ist das möglicherweise als hoch anzusehen (https://expertcouncil.one/wp-content/uploads/2023/03/AG-Impfstoffe-erste-Ergebnisse-Juli-2022_expertcouncil_one.pdf).
Pegylierte Liposomen mit DSPE, Volltreffer bei allen drei zugelassenen Produkten.
Für die anderen Punkte liegen mir leider keine verlässlichen Daten vor.
Es scheint, als wenn alle drei zugelassenen Produkte dafür prädestiniert sind, eine CARPA Reaktion auszulösen und das Puffer und NaCl Problem bei BioNTech/Pfizer das Problem noch verstärkt hat im Vergleich zu Moderna, die gleich TRIS verwendet haben (https://doi.org/10.56098/ijvtpr.v3i1.68),.
Eine CARPA Reaktion sieht dann wie folgt aus:
Da ich kein Mediziner bin, kann ich die Bilder nicht erklären. Ich hoffe einfach, dass wenn ein Mediziner diesen Artikel liest, er mit diesen Schaubildern etwas anfangen kann.
Der Autor dieses Papers hat sich zu diesem seit 2014 bekannten Problem 2022 mit einem Paper bezüglich CARPA und COVID-Impfung geäußert (https://doi.org/10.1007/s11357-021-00495-y), in welcher er die CARPA Reaktion im Menschen natürlich als SELTEN bezeichnet, wie könnte es auch anders sein.
In den Tierversuchen der Publikation sah das dann aber alles anderer als selten aus. Von 14 Schweinen, an denen man das BioNTech/Pfizer Produkt testete (1x, 2x und 5x dosiert) zeigten 6 Tiere CARPA Reaktionen, eines musste wiederbelebt werden und Inkubation mit Schweineserum zeigte bereits Komplementaktivierung. Da fragt man sich schon, wenn Schweine, wie der Autor sagt, perfekte Versuchstiere für CARPA-Reaktionen sind. Warum haben BioNTech/Pfizer und Moderna diese Versuche nicht vor dem weltweiten Impfmaraton durchgeführt? Schweine sind recht günstig zum Fleischpreis zu bekommen, vermute ich, und sind dem Menschen insgesamt deutlich ähnlicher als Mäuse. Zudem ist dieses Schweinemodell für CARPA seit 1999 bekannt (https://doi.org/10.1161/01.cir.99.17.2302). Die Häufigkeit von CARPA liegt zwischen 5% - 45% im Vergleich zu einer Penicillinallergie mit weniger als 2% (https://doi.org/10.4236/health.2013.56138).
Man kann bei diesem Schweineversuch die Überdosierung durchaus kritisieren, sie kam aber in der Realität in einigen Impfzentren vor, die am Anfang, auch durch die verschiedenen Varianten der Produkte, vergessen haben zu verdünnen, falsch verdünnt haben, bzw. einem 40kg leichten Menschen, die gleiche Dosis wie einem 120kg Menschen verpasst haben. Ich schätze, der 40kg leichte Mensch war damit mehrfach überdosiert im Vergleich zu Standardmenschen von ca. 70-80kg.
Entsprechende Biomarker für einen CARPA Nachweis finden sich möglicherweise in diesem Paper (https://doi.org/10.3390/vaccines11061020), aber bei Interleukinen und Blutwerten bin ich als Biologe einfach raus.
Wusste Pfizer darüber Bescheid? Ja! Project Veritas hat ein internes Dokument zugespielt bekommen, in welchem entsprechende Bedenken intern geäußert werden und als Möglichkeit für beobachtete Nebenwirkungen nicht ausgeschlossen werden. Nach außen hat man das aber nicht offen kommuniziert. (https://www.projectveritas.com/news/breaking-confidential-pfizer-documents-reveal-pharmaceuticalgiant-had/).
Waren CARPA Reaktionen BNT162B2 letztendlich auch beim Menschen und nicht nur beim Schwein ein Problem? Ja, hat es und das weiß man seit Mai 2023:
EN: The underlying immunological mechanisms of immediate-type hypersensitivity reactions (HSR) to COVID-19 vaccines are poorly understood. We investigate the mechanisms of immediate-type hypersensitivity reactions to the Pfizer BNT162b2 vaccine and the response of antibodies to the polyethylene glycol (PEG)ylated lipid nanoparticle after two doses of vaccination. […] The basophil activation tests by flow cytometry to the Pfizer vaccine, 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol (DMG-PEG) and PEG-2000 were negative in four anaphylaxis patients. Acute hypersensitivity reactions post BNT162b2 vaccination suggest pseudo-allergic reactions via the activation of anaphylatoxins C5a and are independent of IgE-mechanisms. Vaccine reactors have significantly higher levels of anti-BNT162b2 IgM although its precise role remains unclear.
DE: Die zugrundeliegenden immunologischen Mechanismen von Überempfindlichkeitsreaktionen des Soforttyps (HSR) auf COVID-19-Impfstoffe sind nur unzureichend bekannt. Wir untersuchen die Mechanismen von Überempfindlichkeitsreaktionen des Soforttyps auf den Impfstoff BNT162b2 von Pfizer und die Reaktion von Antikörpern auf den Polyethylenglykol (PEG)ylierten Lipid-Nanopartikel nach zwei Impfdosen. [...] Die durchflusszytometrischen Basophilen-Aktivierungstests für den Pfizer-Impfstoff, 1,2-Dimyristoyl-rac-glycero-3-methoxypolyethylenglycol (DMG-PEG) und PEG-2000 waren bei vier Anaphylaxie-Patienten negativ. Akute Überempfindlichkeitsreaktionen nach der BNT162b2-Impfung deuten auf pseudoallergische Reaktionen über die Aktivierung von Anaphylatoxinen C5a hin und sind unabhängig von IgE-Mechanismen. Impfstoffreagierer weisen signifikant höhere Konzentrationen von Anti-BNT162b2-IgM auf, dessen genaue Rolle jedoch unklar bleibt.
Eine Überempfinglichkeitsreaktion ohne IgE. DAS klingt mir doch schwer nach CARPA (https://doi.org/10.3390/vaccines11061020)
Die EMA extrapolierte, anhand der Daten von DLin-MC3-DMA, dass die ALC-0315 ca. 4-5 Monate im Körper verbleiben.
Der Haken an dieser Extrapolation liegt wie immer im Detail:
Die Ausscheidung der beiden neuen Lipide DLin-MC3-DMA und PEG2000-C-DMG beim Menschen ist weitgehend unbekannt (The elimination in humans of the two new lipids DLin-MC3-DMA and PEG2000-C-DMG is largely unknown) (https://www.ema.europa.eu/en/documents/assessment-report/onpattro-epar-public-assessment-report_.pdf).
Entsprechende experimentelle Messdaten, die das verifizieren würden oder ein experimentell belegter biochemischer Abbauweg wurden von BioNTech/Pfizer NICHT vorgelegt. Es gibt aktuell keine mir bekannten (bio-)chemischen Nachweismethoden der Nanolipide im Körper oder deren möglicher (bisher unbekannter) Abbauprodukte.
Und hier haben wir nun ein kleines Problem mit der Teleskopierung der Studie in Zusammenhang mit einem Nanowirkstoff, dessen Halbwertszeit man nicht kennt:
EN: In general, acute and subacute toxicity must be evaluated for at least ten half-lives which, in the case of nano-drugs mandates a lot of time and cost. Therefore, nano-drugs carry with them greater regulatory costs than typical small molecular drugs.
DE: Im Allgemeinen muss die akute und subakute Toxizität für mindestens zehn Halbwertszeiten bewertet werden, was im Falle von Nanowirkstoffen viel Zeit und Kosten in Anspruch nimmt. Daher sind Nanowirkstoffe mit höheren regulatorischen Kosten verbunden als typische kleinmolekulare Arzneimittel.
Das obige Zitat zur Toxizität stammt aus diesem Paper (https://doi.org/10.1021/acs.bioconjchem.6b00437) aus dem Jahre 2016.
Ob man diese toxikologische Untersuchung von zehn Halbwertszeiten auch teleskopieren kann wie eine Schwangerschaft, vor allem, wenn man die Halbwertszeit gar nicht kennt?
Das ist natürlich eine rein akademische bzw. rhetorische Frage, weil, das hat man gar nicht gemacht:
(https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf)
=== DAS PEG-Problem ===
Neben den kationischen Nanolipiden verwenden alle drei Medikamente zusätzlich drei unterschiedliche PEGylierte Nanolipide.
Immunogenität von Nanomedizinprodukten auf Polyethylenglykolbasis: Mechanismen, klinische Implikationen und systemischer Ansatz (Immunogenicity of Polyethylene Glycol Based Nanomedicines: Mechanisms, Clinical Implications and Systematic Approach) (https://doi.org/10.1002/adtp.201900170)
Dieses Paper lässt sich in wenigen, einfach zu verstehenden Aussagen zusammenfassen, die in meinen Augen massiv gegen den Einsatz von PEGylierten Nanomedikamenten sprechen:
EN: However, in spite of the dogma that PEG is poorly immunogenic, several studies and clinical reports demonstrated that moderate to several immunogenic responses occurred after systemic PEG administration. These side effects that are associated to complement system activation and/or anti-PEG antibodies production, can induce acute hypersensitivity reactions and/or lack of therapeutic efficacy of PEGylated drugs. Many healthy patients that have never been treated with PEGylated drugs, produced naive anti-PEG antibodies in their body.
DE: Entgegen des Dogmas, dass PEG kaum immunogen sind, haben mehrere Studien und klinische Berichte gezeigt, dass nach systemischer Verabreichung von PEG mäßige bis mehrere immunogene Reaktionen auftreten. Diese Nebenwirkungen, die mit der Aktivierung des Komplementsystems und/oder der Bildung von Anti-PEG-Antikörpern einhergehen, können akute Überempfindlichkeitsreaktionen und/oder eine mangelnde therapeutische Wirksamkeit von PEG-haltigen Arzneimitteln hervorrufen. Viele gesunde Patienten, die noch nie mit PEG-haltigen Arzneimitteln behandelt wurden, haben in ihrem Körper naive Anti-PEG-Antikörper gebildet.
EN: incidence of anti-PEG antibodies of 72% on normal healthy patients that never interacted with PEGylated drugs.
DE: Inzidenz von Anti-PEG-Antikörpern von 72 % bei normalen gesunden Patienten, die nie mit PEG-haltigen Arzneimitteln interagiert haben.
EN: Several studies showed that the PEG-coating of nanotherapeutics could trigger the recognition of PEGylated nanomedicines by the cells of the Mononuclear phagocyte system (MPS), upon repeated administrations. In particular, it was demonstrated that the second administration of PEGylated nanocarriers was rapidly cleared from the blood circulation, when administered at a specific time course after the injection of the first dose. This unexpected pharmacokinetic modification, or accelerated blood clearance (ABC) phenomenon, caused a large accumulation of PEGylated nanocarriers in the liver and it was widely studied by Dams et al. and Ishida and Kiwada using PEGylated liposomes.
DE: Mehrere Studien haben gezeigt, dass die PEG-Beschichtung von Nanotherapeutika bei wiederholter Verabreichung die Erkennung von PEGylierten Nanomedikamenten durch die Zellen des mononuklearen Phagozytensystems (MPS) auslösen kann. Insbesondere wurde nachgewiesen, dass die zweite Verabreichung von PEGylierten Nanocarriern schnell aus dem Blutkreislauf entfernt wurde, wenn sie zu einem bestimmten Zeitpunkt nach der Injektion der ersten Dosis verabreicht wurde. Diese unerwartete pharmakokinetische Veränderung oder das ABC-Phänomen (Accelerated Blood Clearance) führte zu einer starken Akkumulation von PEGylierten Nanocarriern in der Leber und wurde von Dams et al. und Ishida und Kiwada unter Verwendung von PEGylierten Liposomen eingehend untersucht.
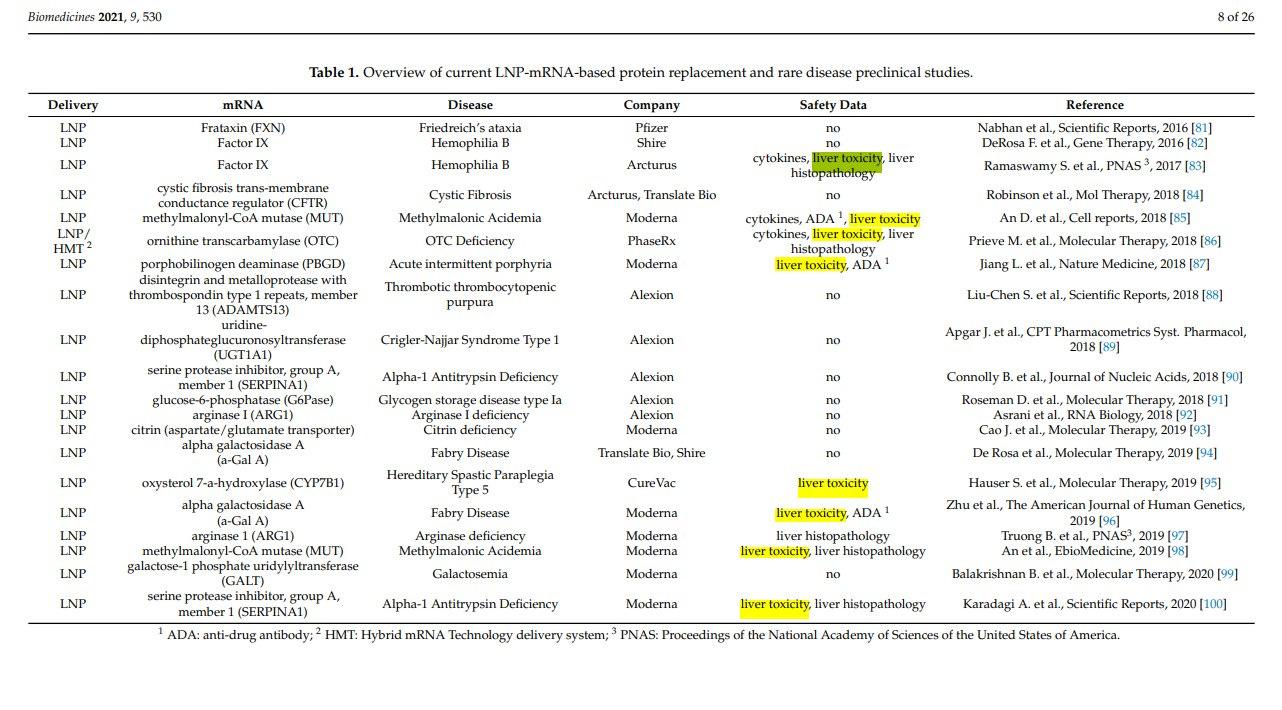
Die Akkumulation in der Leber könnte vielleicht erklären, warum viele modRNA-Therapien ein Problem für die Leber zu sein scheinen (https://doi.org/10.3390/biomedicines9050530)
Aber zurück zu diesem Paper (https://doi.org/10.1002/adtp.201900170)
EN: The immune reaction against PEG caused severe clinical implications after the injection of Doxil/Caelyx. Unfortunately, it was not the only PEGylated nanotherapeutics having adverse reactions in the clinical setting. […] only 13 of 29 patients, enrolled in the study, showed clinical reactions after Doxil exposition; however high levels of SC5b-9 complex in serum were quantified in 21 patients. This data demonstrated that 9 patients have shown complement activation without any clinical symptom.
DE: Die Immunreaktion gegen PEG führte nach der Injektion von Doxil/Caelyx zu schweren klinischen Folgen. Leider war dies nicht das einzige PEGylierte Nanotherapeutikum, das im klinischen Umfeld unerwünschte Reaktionen hervorrief. […] Nur 13 von 29 Patienten, die an der Studie teilnahmen, zeigten klinische Reaktionen nach Doxil-Exposition; allerdings wurden bei 21 Patienten hohe Konzentrationen des SC5b-9-Komplexes im Serum gemessen. Diese Daten zeigen, dass bei 9 Patienten eine Komplementaktivierung ohne klinische Symptome auftrat.
EN: Different strategies are currently developed to overcome the side effects of PEGylated nanotherapeutics and obtain long circulating and safe nanomedicine. Unfortunately, to date no approach addressed completely this issue.
DE: Derzeit werden verschiedene Strategien entwickelt, um die Nebenwirkungen von PEGylierten Nanotherapeutika zu überwinden und lange zirkulierende und sichere Nanomedikamente zu erhalten. Leider gibt es bis heute keinen Ansatz, der dieses Problem vollständig löst.
EN: The elephant in the PEG room is the widespread use ofSARS-CoV-2 RNA vaccines. Important questions remain to be answered, including how many people receiving BNT162b ormRNA-1273 develop antibodies against PEG, how long induced anti-PEG antibodies remain in the circulation, and whether memory B cell responses are generated. (https://doi.org/10.1021/acsnano.1c05922)
DE: Der Elefant im PEG-Raum ist der weit verbreitete Einsatz vonSARS-CoV-2-RNA-Impfstoffen. Wichtige Fragen müssen noch beantwortet werden, z. B. wie viele Personen, die BNT162b odermRNA-1273 erhalten, Antikörper gegen PEG entwickeln, wie lange induzierte Anti-PEG-Antikörper im Blutkreislauf verbleiben und ob B-Zell-Gedächtnisreaktionen erzeugt werden.
Zusammenfassung: 72% aller Menschen haben (möglicherweise, weil PEG in vielen Hautprodukten enthalten ist?) bereits Antikörper gegen PEG. Diese Antikörper können nun entweder dazu führen, dass das Medikament ganz schnell aus dem Blut entfernt wird (was im Falle der Plörre eine sehr gute Nachricht wäre) ABER dann akkumuliert das Produkt in der Leber (was nicht so gut, aber die Leber ist eines der Luxusorgane, das regenerieren kann). Wenn es dumm läuft, wird aber das Komplementsystem aktiviert, was einige Menschen an Symptomen merken, andere nicht. Wie lange das andauern kann ist aktuell unbekannt. Es ist auch unbekannt, ob B-Zellen da ebenfalls involviert sind.
Das Problem war schon laaaaaaaaaaaaaaaange bekannt, wegen eines Krebsmedikamentes Namens Doxil/Caelyx, da weiß man das nämlich mit der CARPA Reaktion schon deutlich länger also vor 2012 (https://doi.org/10.1016/j.jconrel.2012.03.020).
Ansätze, das Problem in den Griff zu bekommen gibt es, gelöst ist es aber nicht. Man arbeitet noch daran. Da gibt es nun viele mögliche Probanden, schätze ich, die in den Hausarztpraxen mit einer CARPA aufschlagen. Da findet sich sicherlich eine Lösung, oder auch nicht, wer weiß.
=== Die biomolekulare Corona der Lipid Nanopartikel ===
Noch eine „Kleinigkeit“, welche BioNTech/Pfizer und Moderna den Zulassungsbehörden in ihren Unterlagen verschwiegen haben, ist die länger bekannte Tatsache, dass Lipid Nanopartikel Kolloide sich einen Corona aus köpereigenen Eiweißen zulegen. Das hat man exakt bei dem Mittel festgestellt, mit welchem BioNTech/Pfizer sich in der Zulassung verglichen hat: Onpattro.
Mehr zur Corona der Plörre (welch Ironie, noch eine Corona), findet man in diesem Review aus dem Jahr 2020 (https://doi.org/10.1021/acs.bioconjchem.0c00366)
EN: Subsequent studies discovered that the key to Onpattro’s liver tropism is its ability to form a specific “biomolecular corona”.
DE: Spätere Studien ergaben, dass der Schlüssel zum Lebertropismus von Onpattro in seiner Fähigkeit liegt, eine spezifische "biomolekulare Korona" zu bilden.
D.h. Onpattro landet vor allem in der Leber, wo es auch hinsoll, weil sich die kolloidalen Partikel eine Corona aus körpereigenen Proteinen zulegen, die dafür sorgen, dass es in der Leber landet.
Wie und warum genau das passiert? Das war wohl einfach nur Glück, weil entdeckt hat man diese Effekte, wie erwähnt, in späteren Studien, also danach, nachdem das Zeug schon in der Anwendung war, vermutlich.
EN: To date, however, only a few studies have explored in detail the corona of LNPs, and how to efficiently modulate the corona remains poorly understood.
DE: Bisher haben jedoch nur wenige Studien die Korona von LNPs im Detail erforscht, und es ist nach wie vor kaum bekannt, wie man die Korona effizient modulieren kann.
EN: In fact, LNPs first interact with biological fluids, whose nature depends on the administration site: from lung surfactants when inhaled, to interstitial fluid when locally injected, to blood plasma following intravenous administration.
The biomolecules in these fluids include electrolytes, lipids, and most importantly proteins, which adsorb on the LNP surface, forming a layer that defines the new biological identity of an LNP: the “biomolecular corona”. This surface coating can be formed by hundreds of biomolecules including apolipoproteins, immunoglobulins, coagulation factors, and many others. Some of these biomolecules might associate almost irreversibly to the LNP surface, in either their native or denatured form, affecting, de facto, all subsequent interactions. It has been proposed that the corona comprises both these tightly bound proteins (“hard” corona), which presumably bind directly to the LNP surface with high affinity, and also a looser, more dynamic layer (“soft” corona) which constantly exchanges with proteins in the environment. The hard and soft corona are both considered to be relevant in determining LNP interactions with cells.
The biomolecular corona can be seen as an LNP surface modification: it can affect particle physicochemical characteristics and therefore stability, blood residency, biodistribution,
immune system recognition, and cell binding. Moreover, the corona can confer, per se, (endogenous) targeting capabilities to the LNP since the presence of certain biomolecules in the LNP corona can facilitate interactions with specific receptors.
DE: Die LNP interagieren nämlich zunächst mit biologischen Flüssigkeiten, deren Beschaffenheit vom Verabreichungsort abhängt: von den Surfactants (https://flexikon.doccheck.com/de/Surfactant) der Lunge bei Inhalation über die interstitielle Flüssigkeit bei lokaler Injektion bis hin zum Blutplasma nach intravenöser Verabreichung. Zu den Biomolekülen in diesen Flüssigkeiten gehören Elektrolyte, Lipide und vor allem Proteine, die an der LNP-Oberfläche adsorbieren und eine Schicht bilden, die die neue biologische Identität eines LNP definiert: die "biomolekulare Korona". Diese Oberflächenbeschichtung kann von Hunderten von Biomolekülen gebildet werden, darunter Apolipoproteine, Immunglobuline, Gerinnungsfaktoren und viele andere. Einige dieser Biomoleküle können sich in ihrer nativen oder denaturierten Form nahezu irreversibel mit der LNP-Oberfläche verbinden, was de facto alle nachfolgenden Wechselwirkungen beeinflusst. Es wurde vorgeschlagen, dass die Korona sowohl diese fest gebundenen Proteine ("harte" Korona), die vermutlich mit hoher Affinität direkt an die LNP-Oberfläche binden, als auch eine lockerere, dynamischere Schicht ("weiche" Korona) umfasst, die in ständigem Austausch mit Proteinen in der Umgebung steht. Sowohl die harte als auch die weiche Korona werden als relevant für die Wechselwirkungen zwischen LNP und Zellen angesehen.
Die biomolekulare Korona kann als eine Modifikation der LNP-Oberfläche angesehen werden: Sie kann die physikalisch-chemischen Eigenschaften der Partikel und damit die Stabilität, die Verweildauer im Blut, die Biodistribution, die Erkennung durch das Immunsystem und die Zellbindung beeinflussen. Darüber hinaus kann die Korona dem LNP per se (endogene) Targeting-Fähigkeiten verleihen, da das Vorhandensein bestimmter Biomoleküle in der LNP-Korona die Interaktion mit spezifischen Rezeptoren erleichtern kann.
Nun ist es jedoch so, dass jeder Mensch unterschiedlich ist. Die Proteine im Blut hängen von der persönlichen genetischen Ausstattung ab und vielleicht von der Ernährung (das kann sogar im Laufe des Tages schwanken, daher gibt man Blut bei Arzt morgens nüchtern ab). Ich schätze mal, mit dem Altern kann das auch noch schwanken. Die biomolekulare Corona wurde aber bei der Plörre meines Wissens für die Zulassung weder erwähnt noch untersucht. Dabei ist sie bei Onpattro der Grund, warum das Medikament so gut funktioniert und BioNTech/Pfizer hatte sich doch mit Onpattro verglichen.
Und nicht nur das, es ist sogar noch komplexer:
EN: While the in vivo journey of LNPs depends on their corona, the nature and dynamics of the biomolecular corona highly depend on the LNP physicochemical characteristics. De facto, any change in LNP composition may affect the biomolecular corona’s composition. In addition, biofluid type (serum, plasma, blood), concentration, temperature, and origin (animal, human, disease) are all critical parameters that can influence the corona and therefore the subsequent nanobio interactions. Thus, even the same LNP tested in different animals, in different patients, or in the same individual over time might acquire different coronas, with potentially important implications for LNP clearance, target tissue accumulation, and efficacy.
DE: Während die in-vivo-Reise von LNPs von ihrer Korona abhängt, hängen die Art und die Dynamik der biomolekularen Korona stark von den physikochemischen Eigenschaften der LNPs ab. De facto kann jede Änderung der LNP-Zusammensetzung die Zusammensetzung der biomolekularen Korona beeinflussen. Darüber hinaus sind die Art der Bioflüssigkeit (Serum, Plasma, Blut), die Konzentration, die Temperatur und die Herkunft (Tier, Mensch, Krankheit) allesamt kritische Parameter, die die Korona und damit die nachfolgenden Nanobio-Wechselwirkungen beeinflussen können. So können selbst ein und dieselben LNP, die an verschiedenen Tieren, Patienten oder Personen getestet wurden, im Laufe der Zeit unterschiedliche Koronas entwickeln, was möglicherweise wichtige Auswirkungen auf die LNP-Clearance, die Anreicherung im Zielgewebe und die Wirksamkeit hat.
Und daher hat man alle Menschen gleich dosiert, mit dem gleichen Mittel behandelt und nicht personalisierte Gentherapie betrieben, wie das normalerweise bei dieser Art Produkt der Fall wäre.
Und das, obwohl man das wusste!
Man hat es nur ignoriert und verschwiegen.
Und hat das Produkt, dessen Formulierung von derartig vielen Faktoren abhängt von Hautcremeproduzenten (Dermapharm und Allergopharm) zusammenrühren lassen. Ja, diese Lipide haben, vor allem PEG, eine Zulassung für AUF DER HAUT. Aber für unter die Haut, da scheint mir doch mehr Knowhow dazuzugehören, als das Wissen um das Anrühren von Cremes.
EN: Efficient translation of LNP formulations relies on rigorous control over physicochemical characteristics such as size, charge, rigidity, and morphology. These parameters are often used to predict the LNP colloidal stability, degradation, biodistribution, and cellular responses. However, these physicochemical properties are altered upon contact with biological fluids.
DE: Eine effiziente Umsetzung von LNP-Formulierungen setzt eine strenge Kontrolle der physikochemischen Eigenschaften wie Größe, Ladung, Steifigkeit und Morphologie voraus. Diese Parameter werden häufig zur Vorhersage der kolloidalen Stabilität, des Abbaus, der biologischen Verteilung und der zellulären Reaktionen von LNP verwendet. Diese physiko-chemischen Eigenschaften verändern sich jedoch bei Kontakt mit biologischen Flüssigkeiten.
Das klingt jetzt echt aufwändig bezüglich der notwendigen Kontrollen und Messungen. Definitiv nach mehr als nur Sichtkontrolle nach Farbe. Und selbst dann ist der Mensch, der es bekommt, eine unbekannte Größe, die das Produkt, je nach Tagesform, Ernährungsstatus, Krankheit, anderweitiger Vorbelastung auch noch biologisch unkontrollierbar modifiziert. Sicher und effektiv scheint mir diese Menge an unkontrollierbaren Variablen nicht zu sein bei Massenanwendung.
EN: The biomolecular corona can activate coagulation cascades and facilitate binding of opsonins such as immunoglobulins, complement factors, and unfolded fibrinogen, which cause recognition and rapid clearance by the mononuclear phagocyte system (MPS). All these phenomena are reported to mitigate efficient nanoparticle delivery into targeted organs and to lower therapeutic efficiency.
Forming a protein layer composed by opsonins around a nanoscale foreign object can be seen as one of the body’s adapted defense mechanisms against infection. De facto, nanoparticle formulations, particularly LNPs for gene therapy, closely resemble certain classes of viruses: they are characterized by a lipid envelope, encapsulate genetic material, and have similar size and curvature.
DE: Die biomolekulare Korona kann die Gerinnungskaskaden aktivieren und die Bindung von Opsoninen wie Immunglobulinen, Komplementfaktoren und ungefaltetem Fibrinogen erleichtern, was zur Erkennung und schnellen Beseitigung durch das mononukleare Phagozytensystem (MPS) führt. Es wird berichtet, dass all diese Phänomene die effiziente Verabreichung von Nanopartikeln in die Zielorgane beeinträchtigen und die therapeutische Wirksamkeit verringern.
Die Bildung einer aus Opsoninen bestehenden Proteinschicht um einen nano großen Fremdkörper kann als einer der angepassten Abwehrmechanismen des Körpers gegen Infektionen angesehen werden. De facto ähneln Nanopartikelformulierungen, insbesondere LNPs für die Gentherapie, bestimmten Klassen von Viren: Sie sind durch eine Lipidhülle gekennzeichnet, verkapseln genetisches Material und haben eine ähnliche Größe und Krümmung.
Und hier schließt sich der Kreis zum ganz am Anfang erwähnten Moderna Börsenbericht und zum CARPA Effekt durch Komplementaktivierung. Von Opsinen war das auch die Rede.
Neu hingegen ist, dass das Nanokolloid vom Körper als Virus angesehen werden könnte und auch so behandelt werden könnte. Haben daher vielleicht einige Menschen keine Nebenwirkungen und auch keine Antikörper nach Schlumpfung gebildet (abgesehen von Chargen, die nicht funktioniert haben, French Press Effekt (der lässt die Kolloidbläschen platzen bei zu kleiner Kanüle), oder weil jemand die Vial geschüttelt hat…). Vielleicht hatten einige Menschen auch Glück, weil eine wiederholte Anwendung des gleichen Nanomaterials einfach eine adaptive Immunantwort auslöst (repeated administrations of the same nanomaterial can induce an adapted immune response) und daher direkt in die Leber entsorgt wird.
EN: Not only the presence of PEG but also its length and surface density are essential to achieving its (the coronas) function.[…] They observed that higherPEG amounts resulted in reduced protein binding and that using PEG with different lipid chain lengths changed the corona composition.
DE: Nicht nur das Vorhandensein von PEG, sondern auch seine Länge und Oberflächendichte sind für die Erreichung seiner (der Cononas) Funktion entscheidend. […] Sie stellten fest, dass höhere PEG-Mengen zu einer geringeren Proteinbindung führten, und dass die Verwendung von PEG mit unterschiedlichen Lipidkettenlängen die Zusammensetzung der Korona veränderte.
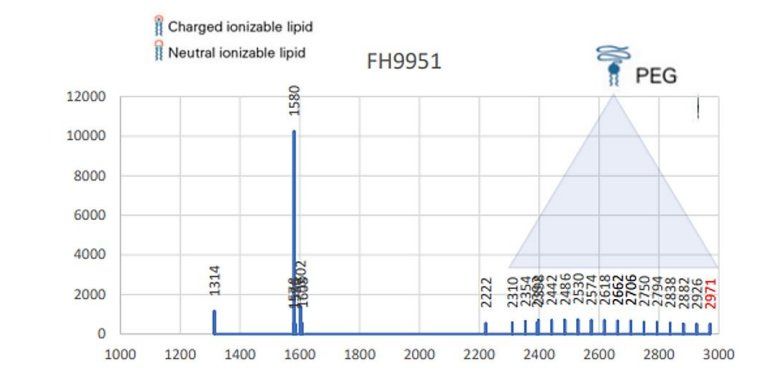
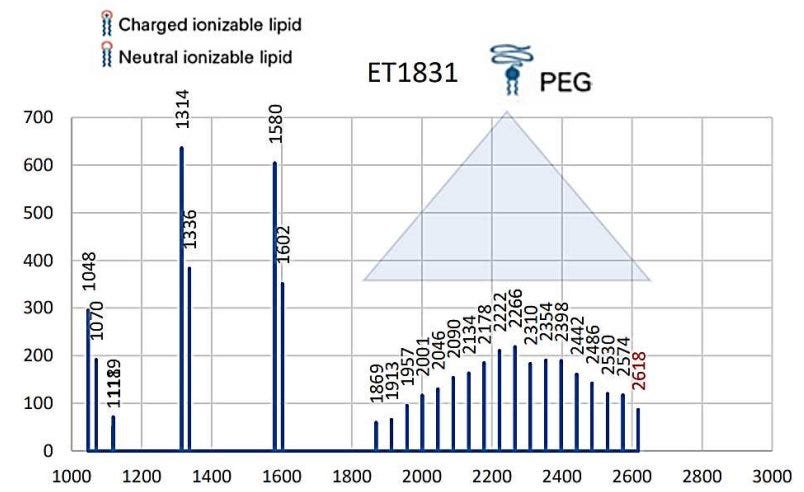
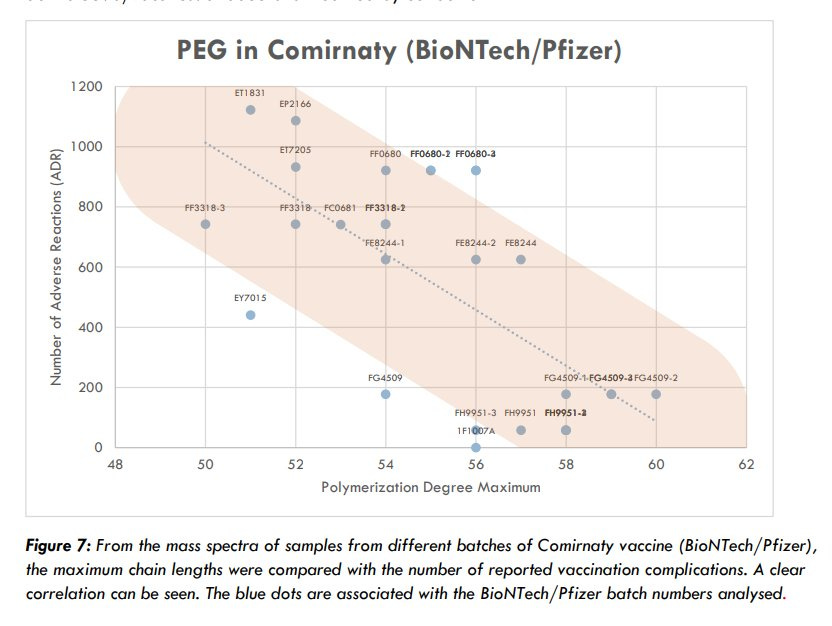
Das schauen wir uns doch mal genauer an. Die AG Impfstoffe des Expertcouncil.one (der ich auch angehöre) hatte dazu 2022 Messungen veröffentlicht (https://expertcouncil.one/wp-content/uploads/2023/03/AG-Impfstoffe-erste-Ergebnisse-Juli-2022_expertcouncil_one.pdf) , die Aufschluss über die PEG Qualität gaben:
„Die Korrelation zwischen Impfkomplikationen und der PEG-Qualität der Chargen weist darauf hin, dass gerade die produktionstechnisch aufwendigen Impfchargen, in denen Nanopartikel nicht zerfallen, die Impfkomplikation (Definition nach EMA) verursachen kann.“
Im Klartext, je besser die Qualität des Impfstoffes in Bezug auf die Einheitlichkeit des PEGylierten Nanolipids, desto mehr schwere Nebenwirkungen (saevere adverse events = SAE).
Das ist nun auch erklärbar. Je länger und diverser die PEG-Ketten, desto schlechter kann sich die Corona ausbilden, die somit indirekt als Effektor auch der BioNTech Produkte nachgewiesen wäre.
Die Kettenlänge schwankte in der Massenspektrometrie massiv und zeugt davon, dass schon bei der Herstellung des PEGylierten Nanonlipids keine entsprechende Qualitätskontrolle mittels MS durchgeführt wurde bzw. die Parameter wohl recht großzügig gewesen sein müssen, was Kettenlänge und Größenstreuung der Kettenlänge angeht.
Die in der dänischen Studie (https://doi.org/10.1111/eci.13998) beobachtete Clusterung kann somit sehr einfach durch die drei Zulieferer (Evonick, Acuitas, Merck) erklärt werden, die unterschiedlich gute Produkte angeliefert haben.
BioNTech/Pfizer und Moderna verwenden andere kationische Nanolipide als Onpattro, man kann also davon ausgehen, dass die Corona sich möglicherweise unterscheiden wird und zwar zwischen allen 3 Produkten. Entsprechende Unterschiede in den Blutwerten zwischen Moderna und BioNTech/Pfizer Geimpften konnten von der Anwaltskanzlei Rogert&Ulbrich beobachtet werden. Man kann angeblich an den Blutwerten ablesen, wer welches Produkt erhalten hat.
Das legt nahe, dass die unterschiedlichen Nanolipide der modRNA-Produkte zu unterschiedlichen Immunreaktionen führen aufgrund der verwendeten Nanolipide und der daraufhin ausgebildeten, unterschiedlichen Coronas.
EN: To summarize, the biomolecular corona is responsible for LNP recognition by the immune system, thereby influencing LNP blood circulation time and biodistribution. Current strategies, such as PEGylation, can alter the LNP corona composition and can confer an increased systemic circulation.
DE: Zusammenfassend lässt sich sagen, dass die biomolekulare Corona für die Erkennung der LNP durch das Immunsystem verantwortlich ist und damit die Dauer der Blutzirkulation und die biologische Verteilung der LNP beeinflusst. Aktuelle Strategien, wie z. B. die PEGylierung, können die Zusammensetzung der LNP-Korona verändern und eine erhöhte systemische Zirkulation bewirken.
EN: Future studies should investigate whether changes in the corona composition might be involved in the altered biodistribution of these different LNPs.
DE: In künftigen Studien sollte untersucht werden, ob Veränderungen in der Zusammensetzung der Korona an der veränderten Biodistribution dieser verschiedenen LNPs beteiligt sein könnten.
In künftigen Studien soll also herausgefunden werden, wie die sowohl von BioNTech/Pfizer als auch von Moderna verschwiegene und für Onpatto essentielle Corona möglicherweise Einfluss auf die Verteilung des Produktes im Körper hat?
Wie verlässlich sich die Biodistributionsdaten aus TIEREN, wenn sich die Corona und somit die Biodistribution schon von Mensch zu Mensch unterscheidet?
=== Die Einstichtiefe bestimmt den Zielort mit ===
Hier lassen wir einfach die Nobelpreisträger Karikó und Weissmann selbst zu Wort kommen (https://doi.org/10.1016/j.jconrel.2015.08.007):
EN: Interestingly, we observed that with intramuscular injection, the depth into the muscle also determined whether the majority of protein produced was in the muscle, for superficial injections, or in the liver, for deep muscular administration (unpublished observations). Importantly, very low doses (0.005 mg/kg) of mRNA-LNPs could be translated for several days following the tested delivery routes demonstrating the potential of these formulations for in vivo development.
DE: Interessanterweise stellten wir fest, dass bei der intramuskulären Injektion die Tiefe des Muskels auch darüber entschied, ob der Großteil des produzierten Proteins im Muskel (bei oberflächlicher Injektion) oder in der Leber (bei tiefer muskulärer Verabreichung) produziert wurde (unveröffentlichte Beobachtungen). Wichtig ist, dass sehr niedrige Dosen (0,005 mg/kg) von mRNA-LNPs nach den getesteten Verabreichungswegen über mehrere Tage übersetzt werden konnten, was das Potenzial dieser Formulierungen für die In-vivo-Entwicklung zeigt.
Dem ist nichts in seiner Brisanz hinzuzufügen. Man hat wohl einfach vergessen, die EMA, FDA und die Ärzte darauf hinzuweisen und daher auch direkt die Aspiration kurz davor abgeschafft.

















How many billions of doses have been given by now? And I keep coming back to the fact that the SAGE group of the WHO told the world in June 2021 in order to get 100% protection from severe disease and hospitalization, all you needed was a COVID19 vaccine based on "old" tech.
https://web.archive.org/web/20210603081843/https://www.who.int/news-room/feature-stories/detail/the-sinovac-covid-19-vaccine-what-you-need-to-know#:~:text=100%25%20against%20severe%20covid-19%2C%20and%20100%25%20against%20hospitalization%20starting%2014%20days%20after%20receiving%20the%20second%20dose.
Wie viele Ihrer Leser wissen, dass Endotoxin Lipid A das von BioNTech Pfizer bevorzugte „Adjuvans“ ist, wie es in ihren Patenten steht?