Ugurs grenzdebile Schwachsinnsideen im Protein Design
Teil 4: Warum es eine grenzdebil schwachsinnige Idee war, N1-Methylpseudouridin (m1Ψ) zu verwenden.
Eine der bekanntesten und klassischsten Formen der Propaganda oder Meinungsmanipulation ist die Methode der Auslassung oder verkürzten Erzählung. Man lügt nicht direkt, man lässt jedoch für die Meinungsbildung wichtige Informationen weg.
Diese Methode der Manipulation wurde bei der Geschichte der Verwendung von N1-Methylpseudouridin angewandt.
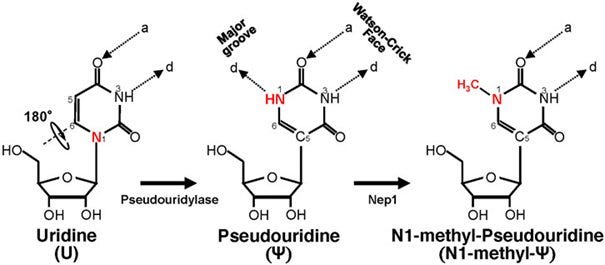
N1-Methylpseudouridin (abgekürzt m1Ψ) ist ein synthetisches Nukleosid (RNA/DNA-Baustein) und kommt in den COVID-19-Impfstoffen von BioNTech/Pfizer und Moderna zum Einsatz statt eines Uracil in der natürlichen mRNA. Nicht zu verwechseln mit Pseudouridine (abgekürzt Ψ), welches sich in Vergleichsuntersuchungen unterschiedlich verhält, aber gerne mit m1Ψ verwechselt oder gleichgesetzt wird.
m1Ψ wird vom Köper auch in sehr speziellen RNAs verwendet wie 18S rRNA (also ribosomale RNA, vielleicht mit eine Ursache für Mitochondriopathie?) und tRNAs. Man weiß also seit 1978, dass 18S rRNA m1Ψ enthält. Es reicht, zu erfassen, dass die Verwendung von m1Ψ in der menschlichen DNA durchaus verbreiteter sein könnte, als bekannt und dass man behauptet hat, dass es sich um ein synthetisches, nicht natürlich vorkommendes Nucleosid handelt und dieses daher sicher wäre. Sieht mir irgendwie sehr natürlich und potentiell sehr häufig aus. Da aber eine Sequenzierung und somit Bestimmung aktuell extrem schwierig ist[1], ist ein Nachweis schwer zu führen, und mögliche unbekannte biologische Funktion daher ebenfalls unbekannt. Ein Satz, in dem das Wort „unbekannt“ gleich zweimal vorkommt, sollte einem Sorgen machen.
Der Unterschied zwischen DNA und RNA besteht darin, dass statt der Base Thymine (T) ein Uracil (U) verbaut wird. Die chemischen Details sind für das aktuelle Problem irrelevant. Man muss nur verstehen, DNA hat Ts und RNA hat Us statt Ts.
Laut den Herstellern wurden angeblich sämtliche U in der mRNA durch m1Ψ ersetzt und die klassische mRNA somit zu modRNA (modifizierter mRNA). Der Beweis jedoch steht aus, da es aktuell, wie bereits erwähnt, sehr schwierig ist, den Einbau von m1Ψ per Sequenzierung überhaupt nachzuweisen. Ob wirklich 100% der Us durch m1Ψ oder nur ein gewisser Prozentsatz ersetzt wurden, wäre noch von Seiten der Hersteller zu belegen.
Ψ erhöht bereits die Stabilität von modRNA, inwieweit m1Ψ sich darin unterscheidet und möglicherweise zu noch höherer Stabilität führt, ist nicht gut untersucht.
Ψ kommt auch natürlich in Zellen vor in sehr konservierter Form und man vermutet, dass diesem Nucleosid spezielle essentielle Funktionen zukommen, da Defekte zu Krankheiten führen können. Ψ ist ein Biomarker für Alzheimer und einige Krebsarten[2].
Die Ursprünglichen Versuche zur modRNA von Kariko und Weissman[3] wurden mit Ψ durchgeführt. Die Eigenschaften von m1Ψ sind in der Literatur deutlich schlechter untersucht und charakterisiert. Bereits 2008[4] wussten diese Autoren, von denen Kariko im Senior Team von BioNTech war[5], dass Ψ die Translation, also die Übersetzung von mRNA (in diesem Fall bereits modRNA) in Proteine erhöht.
Wir haben in Teil 1 der Reihe gelernt:
Die Geschwindigkeit der Translation im Verhältnis zur Faltungsgeschwindigkeit ist von zentraler Bedeutung für den Ausgang und das Ergebnis der co-translationalen Faltung.
Und in Teil 3, dass Proteine in hohen Konzentrationen thermodynamisch instabil sind und daher zur Aggregation neigen
Man wusste also bereit 2008, dass modRNA zu einer deutlich erhöhten Proteinproduktion führt und hat die damit einhergehenden Konsequenzen für die Proteinfaltung ignoriert bzw. nicht untersucht.
Es ist weiterhin bekannt, dass wenn man Ψ in Stop-Codons verbaut, diese überlesen werden können[6] und zu einem größeren Protein mit Strukturen führt, die dieses nicht haben sollte.
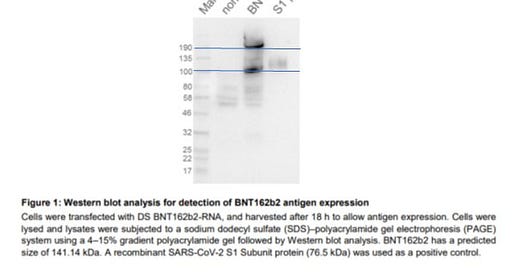
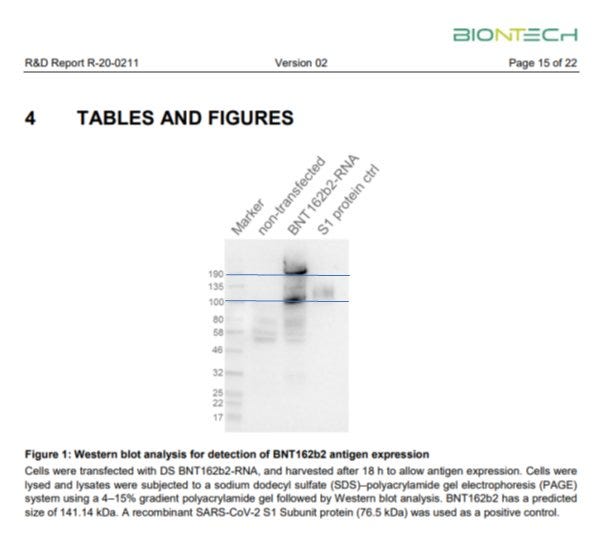
Für m1Ψ ist das bisher nicht gut untersucht. Angeblich soll dieses Problem nicht existieren. Dem widersprechen aber die von Pfizer/BioNTech vorgelegten Daten, die zu große Spike Proteine aufweisen, was ein überlesen der Stop-Codons nahe legt[7].
Die EMA hat das mit 190kDA statt 141 KDa und somit deutlich zu großes Protein in ihren Bericht dementsprechend auch gerügt[8]. Das Problem ist also bekannt, wird aber ignoriert. Es könnte sein, dass der Poly-A Schwanz der RNA als Protein mit übersetzt wird, weil das Stop-Codon wegen des verbauten m1Ψ nicht als Stop erkannt und überlesen wird. Wie sich ein derartig verlängertes und verändertes Protein faltet und verhält, wurde bisher leider nicht charakterisiert.
Von m1Ψ ist jedoch bekannt, dass es die Dynamik der Ribosomen beeinflusst und somit die Geschwindigkeit der Proteinproduktion[9]. m1Ψ erhöht die Proteinproduktion noch einmal um das 6fache bis 13fache im Vergleich zu Ψ[10].
Kurzum, man brüstet sich bei der Verwendung von m1Ψ in den Covid-Impfungen von Moderna und BioNTech/Pfizer exakt mit den Eigenschaften, die bei der Proteinfaltung seit Jahrzehnten als Problem bekannt sind:
1. höhere Proteinkonzentration, was zu Aggregation führen kann und
2. Direkte Einflussnahme des m1Ψ auf das Protein produzierende Ribosom auf eine Art und Weise, von der man in der wissenschaftlichen Literatur zugibt, nicht exakt verstanden zu haben[11].
Was kann da schon schief gehen, wenn man gleich an zwei Stellschrauben, von denen man teilweise offen zugibt, sie nicht zu verstehen, ohne Sinn und Verstand herumdreht.
Eine wirklich intellektuell spannende Frage, die sich mir in diesem Zusammenhang auch stellt… 18S ribosomal RNA verwendet m1Ψ... Zellen recyceln Baustoffe gerne, das lernt man im ersten Semester in Zellbiologie im Grundstudium. Was passiert wohl, wenn man plötzlich ein Überangebot an m1Ψ hat, mit der 18S RNA in den Ribosomen der Zelle oder mit der 16S rRNA der Mitochondrien?
Eine Antwort darauf findet man in folgendem Paper:
Huaier Effects on Functional Compensation with Destructive Ribosomal RNA Structure after Anti-SARS-CoV-2 mRNA Vaccination. (n.d.). https://www.fortunejournals.com/articles/huaier-effects-on-functional-compensation-with-destructive-ribosomal-rna-structure-after-antisarscov2-mrna-vaccination.html
Und diese Antwort macht richtig schlechte Laune und verdient einen eigenen Artikel.
Einmal mit Profis arbeiten, kann ich dazu nur sagen.
[1] Dai Q, Zhang LS, Sun HL, Pajdzik K, Yang L, Ye C, Ju CW, Liu S, Wang Y, Zheng Z, Zhang L, Harada BT, Dou X, Irkliyenko I, Feng X, Zhang W, Pan T, He C. Quantitative sequencing using BID-seq uncovers abundant pseudouridines in mammalian mRNA at base resolution. Nat Biotechnol. 2023 Mar;41(3):344-354. doi: 10.1038/s41587-022-01505-w. Epub 2022 Oct 27. PMID: 36302989; PMCID: PMC10017504. https://pubmed.ncbi.nlm.nih.gov/36302989/
[2] Morais P, Adachi H, Yu YT. The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines. Front Cell Dev Biol. 2021 Nov 4;9:789427. doi: 10.3389/fcell.2021.789427. PMID: 34805188; PMCID: PMC8600071. https://pubmed.ncbi.nlm.nih.gov/34805188/
[3] Karikó K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 2005 Aug;23(2):165-75. doi: 10.1016/j.immuni.2005.06.008. PMID: 16111635. https://pubmed.ncbi.nlm.nih.gov/16111635/
[4] Karikó K, Muramatsu H, Welsh FA, Ludwig J, Kato H, Akira S, Weissman D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther. 2008 Nov;16(11):1833-40. doi: 10.1038/mt.2008.200. Epub 2008 Sep 16. PMID: 18797453; PMCID: PMC2775451. https://pubmed.ncbi.nlm.nih.gov/18797453/
[5] Unser Senior Team. (n.d.). https://www.biontech.com/de/de/home/about/our-senior-team.html
[6] Morais P, Adachi H, Yu YT. The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines. Front Cell Dev Biol. 2021 Nov 4;9:789427. doi: 10.3389/fcell.2021.789427. PMID: 34805188; PMCID: PMC8600071. https://pubmed.ncbi.nlm.nih.gov/34805188/
[7] https://phmpt.org/wp-content/uploads/2023/02/125742_S1_M4_4.2.1-r-20-0211.pdf Seite 15
[8] https://www.covidtruths.co.uk/wp-content/uploads/2021/04/Rapporteur-Rolling-Review-Report-Overview-LoQ-COVID-19-mRNA-Vaccine-BioNTech.docx S. 61
[9] Svitkin YV, Cheng YM, Chakraborty T, Presnyak V, John M, Sonenberg N. N1-methyl-pseudouridine in mRNA enhances translation through eIF2α-dependent and independent mechanisms by increasing ribosome density. Nucleic Acids Res. 2017 Jun 2;45(10):6023-6036. doi: 10.1093/nar/gkx135. PMID: 28334758; PMCID: PMC5449617. https://pubmed.ncbi.nlm.nih.gov/28334758/
[10] Andries O, Mc Cafferty S, De Smedt SC, Weiss R, Sanders NN, Kitada T. N(1)-methylpseudouridine-incorporated mRNA outperforms pseudouridine-incorporated mRNA by providing enhanced protein expression and reduced immunogenicity in mammalian cell lines and mice. J Control Release. 2015 Nov 10;217:337-44. doi: 10.1016/j.jconrel.2015.08.051. Epub 2015 Sep 3. PMID: 26342664. https://pubmed.ncbi.nlm.nih.gov/26342664/
[11] Chen TH, Potapov V, Dai N, Ong JL, Roy B. N1-methyl-pseudouridine is incorporated with higher fidelity than pseudouridine in synthetic RNAs. Sci Rep. 2022 Jul 29;12(1):13017. doi: 10.1038/s41598-022-17249-1. PMID: 35906281; PMCID: PMC9335462. https://pubmed.ncbi.nlm.nih.gov/35906281/